
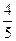 ×45 mL="36" mL
×45 mL="36" mL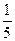 ×45 mL+5 mL="14" mL
×45 mL+5 mL="14" mL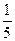 ×35 mL="7" mL
×35 mL="7" mL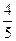 ×35 mL+15 mL="43" mL
×35 mL+15 mL="43" mL

科目:高中化学 来源:不详 题型:单选题
| A.x≤1.5 | B.x="3.5" | C.x="1.2" | D.x≥1.5 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.砷在通常状况下为固体? |
| B.As2O3对应水化物的酸性比H3PO4弱? |
| C.可以有-3、+3、+5等多种化合价? |
| D.砷的还原性比磷弱? |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.只有PCl3 | B.只有PCl5 | C.PCl3和PCl5 | D.无法确定 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.非金属性逐渐增强 |
| B.熔沸点逐渐降低 |
| C.RH3还原性逐渐增强 |
| D.最高价氧化物对应的水化物的酸性逐渐增强 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

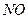 氧化成
氧化成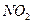 ;③水吸收
;③水吸收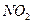
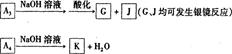
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com