
一定量的盐酸跟过量的铁粉反应时,为了减缓反应速率,且不影响生成氢气的总量,可向盐酸中加入适量的
①NaOH(固体) ②H2O ③HCl ④CH3COONa(固体)
A.①② B.②③ C.③④ D.②④
科目:高中化学 来源:2015-2016学年黑龙江哈尔滨附属中学高二上期中化学试卷(解析版) 题型:选择题
某反应2AB(g) C(g)+3D(g)在高温时能自发进行,其逆反应在低温时能自发进行,则该反应的ΔH、ΔS应为
C(g)+3D(g)在高温时能自发进行,其逆反应在低温时能自发进行,则该反应的ΔH、ΔS应为
A.ΔH<0,ΔS>0 B.ΔH<0,ΔS<0 C.ΔH >0,ΔS>0 D.ΔH >0,ΔS<0
查看答案和解析>>
科目:高中化学 来源:2016届陕西省高三上学期第三次月考化学试卷(解析版) 题型:填空题
某化工厂冶炼金属、回收硫的工艺流程如下:

I.回收硫
(1)工业上,采用饱和亚硫酸钠溶液吸收烟气中二氧化硫,写出离子方程式: 。然后,加热吸收液收集SO2。将二氧化硫、空气在稀硫酸中构成原电池,负极反应式为 。
II.冶炼铜
(2)工业上,火法冶炼铜分两步:第一步,含铜矿(主要成分是Cu2S)在空气中煅烧生成氧化亚铜和刺激性气味气体;第二步,氧化亚铜和铜矿在高温下反应生成铜和刺激性气体。写出冶炼铜的总反应方程式: 。
(3)用电解法精炼粗铜(含银、金、铁、锌杂质),装置如图所示。下列说法不正确的是 。
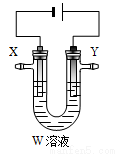
A.Y极为粗铜、X极为纯铜
B.X极净增质量等于Y极净减质量
C.铜盐溶液作精炼铜的电解质溶液
D.若电路有1 mol电子转移,则X极净增32 g
(4)几种金属离子的沉淀pH:
金属氢氧化物 | 开始沉淀pH | 完全沉淀的pH |
Fe(OH)3 | 2.7 | 3.7 |
Fe(OH)2 | 7.6 | 9.7 |
Cu(OH)2 | 4.6 | 6.4 |
Zn(OH)2 | 5.9 | 8.9 |
铜盐溶液中Fe2、Zn2+对精炼铜可能会产生影响。工业上,除去Fe2+方法是,在酸性混合溶液中加入 (选填:双氧水、次氯酸钠、氯水或高锰酸钾溶液)将Fe2+氧化成Fe3+,离子方程式为 。加入碱调节溶液pH范围为 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年宁夏银川市高一上学期期中测试化学试卷(解析版) 题型:选择题
容量瓶上标有的标记为
①使用温度 ②浓度 ③容积 ④压强 ⑤刻度线 ⑥酸式或碱式
A.③⑤⑥ B.①③⑤ C.①②④ D.②④⑥
查看答案和解析>>
科目:高中化学 来源:2015-2016学年浙江省台州市高一上学期第一次月考化学试卷(解析版) 题型:选择题
某溶液中只含有Na+、Al3+、Cl-、SO42- 四种离子,已知前三种离子的个数比为3∶2∶1,则溶液中Al3+和 SO42-的离子个数比为
A.1∶4 B.1∶2 C.3∶4 D.3∶2
查看答案和解析>>
科目:高中化学 来源:2015-2016学年浙江省台州市高二上学期第一次月考化学试卷(解析版) 题型:选择题
银锌电池广泛用做各种电子仪器的电源,它的电池反应是:Zn+Ag2O+H2O=2Ag+Zn(OH)2,则负极上发生反应的物质是
A.Ag B.Zn(OH)2 C.Ag2O D.Zn
查看答案和解析>>
科目:高中化学 来源:2016届河南省顶级名校高三上学期期中测试化学试卷(解析版) 题型:选择题
下列表示对应化学反应的离子方程式正确的是
A.向稀HNO3中滴加Na2SO3溶液:SO32-+2H+ = SO2↑+ H2O
B.向Na2SiO3溶液中通入过量SO2:SiO32-+SO2 +H2O = H2SiO3↓+SO32-
C.Na2S2O3溶液中加入稀硫酸:2S2O32-+4H+=SO42-+3S↓+2H2O
D.向CuSO4溶液中加入Na2O2:2Na2O2 +2Cu2++2H2O=4 Na++2Cu(OH)2↓+O2↑
查看答案和解析>>
科目:高中化学 来源:2015-2016学年四川省高二上10月月考化学试卷(解析版) 题型:选择题
.已知反应4CO+2NO2 N2+4CO2在不同条件下的化学反应速率如下,其中表示反应速率最快的是
N2+4CO2在不同条件下的化学反应速率如下,其中表示反应速率最快的是
A.v(CO)=1.5mol·L-1·min-1
B.v(NO2)=0.7mol·L-1·min-1
C.v(N2)=0.4mol·L-1·min-1
D.v(CO2)=1.1mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖北省黄石市高一上11月期中月考化学试卷(解析版) 题型:选择题
常温下,某100 mL溶液中含H2SO4 0.50 mol,加入下列物质,使溶液的导电性增强的是
A.0.50 mol Ba(OH)2
B.100 mL水
C.0.50 mol酒精
D.0.50 mol Na2SO4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com