
【题目】淡黄色固体A和气体X存在如下转化关系:
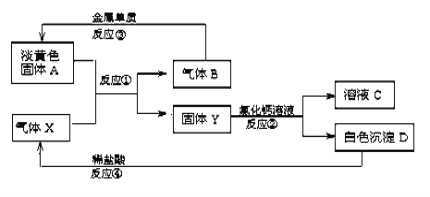
请回答下列问题:
(1)固体A的名称____________,X的化学式 ____________。
(2)反应③的化学方程式为____________________。
(3)写出反应②的离子方程式________________________。
【答案】过氧化钠 CO2 2Na + O2![]() Na2O2 Ca2++CO32-= CaCO3↓
Na2O2 Ca2++CO32-= CaCO3↓
【解析】
由转化关系可以知道,淡黄色固体A能与气体X反应生成固体Y与气体B,所以该反应为过氧化钠与二氧化碳反应,由此可推知淡黄色固体A为Na2O2,气体X为CO2,固体Y为Na2CO3,反应生成的气体为O2;碳酸钠与氯化钙溶液反应生成白色沉淀为CaCO3,所得溶液为NaCl溶液;
(1)由上述分析可以知道,固体A为过氧化钠;X的化学式为: CO2;综上所述,本题答案是:过氧化钠 ,CO2 。
(2) 金属钠与氧气反应生成过氧化钠,反应③的化学方程式为2Na + O2![]() Na2O2 ;综上所述,本题答案是: 2Na + O2
Na2O2 ;综上所述,本题答案是: 2Na + O2![]() Na2O2。
Na2O2。
(3)碳酸钠溶液与氯化钙溶液反应生成碳酸钙沉淀和氯化钠,反应②的离子方程式:Ca2++CO32-= CaCO3↓;综上所述,本题答案是:Ca2++CO32-= CaCO3↓。


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:
【题目】铝石墨双离子电池是一种全新低成本、高效电池。原理为:A1Li+Cx(PF6)![]() Al+xC+Li++PF6-。电池结构如图所示。下列说法正确的是
Al+xC+Li++PF6-。电池结构如图所示。下列说法正确的是

A. 放电时,外电路中电子向铝锂电极移动
B. 放电时,正极反应为Cx(PF6)+e-=xC+PF6-
C. 充电时,应将铝石墨电极与电源负极相连
D. 充电时,若电路中通过1 mol电子,阴极质量增加9 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】德国化学家哈伯从1902 年开始研究由氮气和氢气直接合成氨,反应原理为:N2(g)+3H2(g)![]() 2NH3(g) △H=-92.4kJmol-1
2NH3(g) △H=-92.4kJmol-1
(1)在恒温恒容条件下,向反应平衡体系中充入氮气,达到新平衡时,c(H2)将_________(填“增大”、“减小”、“不变”或“无法判断”,下同),c(N2)·c3(H2)将___________。
(2)工业上可用CH4与水蒸气制氢气:CH4(g)+H2O(g)![]() CO(g)+3H2(g)。在200℃时2L的密闭容器中,将1molCH4和1mol H2O(g)混合,达平衡时CH4 的转化率为80%。则200℃时该反应的平衡常数K=______________(保留一位小数)。
CO(g)+3H2(g)。在200℃时2L的密闭容器中,将1molCH4和1mol H2O(g)混合,达平衡时CH4 的转化率为80%。则200℃时该反应的平衡常数K=______________(保留一位小数)。
(3)如图为合成氨反应在不同温度和压强、使用相同催化剂条件下,初始时氮气、氢气的体积比为1:3 时,平衡混合物中氨的体积分数。若分别用vA(NH3)和vB(NH3)表示从反应开始至达平衡状态A、B 时的化学反应速率,则vA(NH3)____ ( 填“>”“<”或“=”)vB(NH3)。

(4)工业生产中逸出的氨可用稀硫酸吸收。若恰好生成NH4HSO4,该溶液中各离子的物质的量浓度由大到小的顺序是______________________。
(5)H2NCOONH4是工业合成尿素的中间产物,该反应的能量变化如图所示,用CO2和氨合成尿素的热化学方程式为_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】扁桃酸衍生物是重要的医药中间体,以A、B为原料合成扁桃酸衍生物F路线如下:
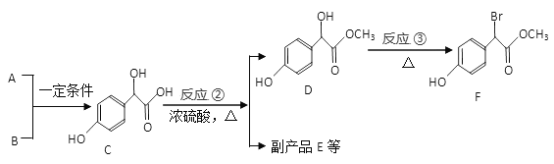
(1) A 的分子式为C2H2O3,1molA 能消耗含有2.5 molCu(OH)2 新制悬浊液,写出反应①的化学方程式_______________________________。
(2)化合物C 所含官能团名称为______________,在一定条件下C 与足量NaOH 溶液反应,1molC 最多消耗NaOH 的物质的量为_________________mol。
(3)反应②的反应类型为___________; 请写出反应③的化学方程式_____________________________。
(4)E 是由2 个分子C生成的含有3 个六元环的化合物,E 的分子式为____________________。
(5)符合条件的F 的所有同分异构体(不考虑立体异构) 有__________种,其中核磁共振氢谱有五组峰的结构简式为____________________。
①属于一元酸类化合物; ②苯环上只有2 个取代基 ③遇FeCl3 溶液显紫色
(6)参照上述合成路线。以冰醋酸为原料(无机试剂任选)设计制备A 的合成路线。己知RCH2COOH ![]() RCH(Cl)COOH______________________
RCH(Cl)COOH______________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生活中有许多与化学相关的数据表格。
Ⅰ.下图是某儿童微量元素体检报告单的部分数据:某医疗机构临床检验结果报告单
分析项目 | 检测结果 | 单位 | 参考范围 | |
1 | 锌(Zn) | 115.92 | μmol/L | 66~120 |
2 | 铁(Fe) | 6.95 | mmol/L | 7.52~11.82 |
3 | 钙(Ca) | 1.68 | mmol/L | 1.55~2.10 |
…… |
根据上表的数据,回答下列问题:
(1)该儿童__________元素含量偏低。
(2)报告单中“μmol/L”是__________(填“质量”、“体积”或“浓度”)的单位。
(3)服用维生素C可使食物中的Fe3+转化为Fe2+,在这个过程中体现维生素C的__________(填“氧化性”或“还原性”)。
Ⅱ.生活中为了延长鲜花的寿命,通常会在花瓶中加入鲜花保鲜剂。下表是0.5L某种鲜花保鲜剂中含有的成分及含量,阅读后回答下列问题:
成分 | 质量(g) | 摩尔质量(g/mol) |
①蔗糖(C12H22O11) | 25.00 | 342 |
0.25 | 174 | |
③高锰酸钾(KMnO4) | 0.25 | 158 |
④阿司匹林(C9H8O4) | 0.17 | 180 |
⑤硝酸银(AgNO3) | 0.02 | 170 |
(4)上述鲜花保鲜剂成分中,属于盐的是__________(填序号)。
(5)欲配制500mL该鲜花保鲜剂,有如下操作步骤:
a.把称量好的保鲜剂放入小烧杯中,加适量蒸馏水溶解;
b.把a所得溶液小心转入500mL容量瓶中;
c.继续向容量瓶中加蒸馏水至液面距刻度1cm~2cm处,改用胶头滴管小心滴加蒸馏水至溶液凹液面最低处与刻度线相切;
d.用少量蒸馏水洗涤烧杯和玻璃棒2~3次,每次洗涤液都小心转入容量瓶,并轻轻摇匀;
e.将容量瓶塞紧,反复上下颠倒摇匀。
①操作步骤的正确顺序为(填序号)__________。
②在容量瓶的使用方法中,下列操作不正确的是__________。
A.使用容量瓶前检查它是否漏水
B.容量瓶用蒸馏水洗净后,需要干燥
C.盖好瓶塞,用一只手的食指顶住瓶塞,另一只手的手指托住瓶底,把容量瓶倒转和摇动几次
(6)写出该鲜花保鲜剂中K+的物质的量浓度的计算式c(K+)=__________ mol·L1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳、氮及其化合物与生活密切相关。请根据要求回答下列问题:
(1)用CH4催化还原氮氧化物可以消除氮氧化物的污染。已知:
①CH4(g)+4NO2(g)= 4NO(g)+CO2(g)+2H2O(g) △H=-574kJ/mol
②CH4(g)+4NO(g)= 2N2(g)+CO2(g)+2H2O(g) △H=-l160kJ/mol
③H2O(g)= H2O(l) △H=-44kJ/mol
写出CH4(g)与NO2(g)反应生成N2(g)、CO2(g)和H2O( 1) 的热化学方程式_________。
(2)已知: 反应I: 4NH3(g)+5O2(g) ![]() 4NO(g)+6H2O(g) △H < 0
4NO(g)+6H2O(g) △H < 0
反应II: 4NH3(g)+3O2(g) ![]() 2N2(g)+6H2O(g) △H < 0
2N2(g)+6H2O(g) △H < 0
①在恒温恒容装置中充入一定量的NH3 和O2,在催化剂的作用下进行反应I,则下列有关叙述中正确的是___(填字母序号)。
A.增大压强,Kp(用压强表示的化学平衡常数) 增大
B.若测得容器内3v正(NH3)=2v逆(H2O) 时,说明反应已达平衡
C.升高温度,NH3 的转化率增大
D.达到平衡时体系的压强不再变化
②氨催化氧化时会发生上述两个竞争反应I、II。为分析某催化剂对该反应的选择性,在1L密闭容器中充入1molNH3和2molO2,得有关物质的量关系如图,该催化剂在高温时选择反应_____(填“I”或“II”)。
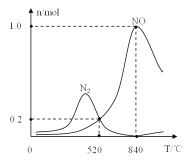
③520℃时,4NH3(g)+3O2 (g)![]() 2N2(g)+6H2O(g)的平衡常数K=_______(只需列出数字计算式)。提高NH3转化为N2平衡转化率的措施有______( 填字母序号)
2N2(g)+6H2O(g)的平衡常数K=_______(只需列出数字计算式)。提高NH3转化为N2平衡转化率的措施有______( 填字母序号)
A.降低反应温度 B.将反应生成的H2O(g)及时移出
C.增大NH3和O2的初始投料比 D.投料比不变,增加反应物的浓度
(3)己知25℃时HCN 和H2CO3的电离常数(Ka.)如下表:
物质 | 电离常数(Ka) |
HCN | Ka=5×10-10 |
H2CO3 | Ka1=4.5×10-7;Ka2=4.7× 10-11 |
25℃时,测得HCN 和NaCN 的混合溶液pH=11,则c(HCN)/c(CN-)=____。向NaCN 溶液中通入少量CO2,则发生反应的离子方程式为:__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com