
| A. | 乙二醇的水溶液凝固点很低,可作汽车发动机的抗冻剂 | |
| B. | 丙三醇的沸点比乙二醇的沸点高,可用于配制化妆品 | |
| C. | 这两种多元醇都易溶于水,但难溶于有机溶剂 | |
| D. | 丙三醇可以制造炸药,乙二醇是制涤纶的主要原料 |
分析 A.乙二醇的水溶液凝固点很低;
B.碳原子数越多,羟基数越多,沸点越高;
C.乙二醇和丙三醇易溶于乙醇,也易溶于水;
D.硝酸甘油是炸药;涤纶是以对苯二甲酸或对苯二甲酸二甲酯和乙二醇为原料经酯化或酯交换和缩聚反应而制得的成纤高聚物-聚对苯二甲酸乙二醇酯.
解答 解:A.乙二醇的水溶液凝固点很低,可作汽车发动机的抗冻剂,故A正确;
B.丙三醇比乙二醇羟基个数多,碳原子数也多,所以丙三醇沸点应比乙二醇的沸点高,且丙三醇具有吸湿性,能用作配制化妆瓶,故B正确;
C.这两种多元醇易溶于乙醇,也易溶于水,故C错误;
D.丙三醇可以制造硝酸甘油,乙二醇是制造涤纶的主要原料,故D正确.
故选C.
点评 本题主要考查的多元醇(乙二醇和丙三醇)的性质,类比乙醇的性质以及掌握羟基的性质是关键,题目难度中等,注意硝酸甘油是炸药.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.  ;D与E能形成一种所有原子最外层均满足8电子的分子,该分子的结构式为S=C=S;D所在族元素的氢化物中,沸点最低的是H2S.
;D与E能形成一种所有原子最外层均满足8电子的分子,该分子的结构式为S=C=S;D所在族元素的氢化物中,沸点最低的是H2S.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
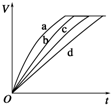 等质量的铁与过量的盐酸在不同的实验条件下进行反应,测定在不同时间t产生氢气体
等质量的铁与过量的盐酸在不同的实验条件下进行反应,测定在不同时间t产生氢气体| 组别 | c(HCl)/(mol•L-1) | 温度/(℃) | 状态 |
| 1 | 2.0 | 30 | 块状 |
| 2 | 2.5 | 30 | 块状 |
| 3 | 2.0 | 20 | 块状 |
| 4 | 2.5 | 30 | 粉末状 |
| A. | 4、3、2、1 | B. | 4、2、1、3 | C. | 3、4、2、1 | D. | 4、1、2、3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| t℃ | 700 | 800 | 850 | 1000 | 1200 |
| K | 2.6 | 1.7 | 1.0 | 0.9 | 0.6 |

| 化学式 | 电离平衡常数 |
| HCN | K=4.9×10-10 |
| H2CO3 | K1=4.3×10-7、K2=5.6×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①是非氧化还原反应,而②是氧化还原反应 | |
| B. | 上述反应中SO2的作用只相当于催化剂 | |
| C. | 反应②中CuSO4是氧化产物 | |
| D. | 反应①中SO2发生还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 配制CuCl2溶液时,将CuCl2(s)溶于浓HCl后再加水冲稀,浓盐酸作用:有利于抑制CuCl2水解,可防止Cu(OH)2的形成 | |
| B. | 加热MnO2的浓HCl溶液制取氯气.浓盐酸作用:有利于减少氯气的溶解损失 | |
| C. | 浓硝酸不能溶解金,需用浓HCl溶液配制王水才能溶解金.浓盐酸作用:有利于增强Au的还原性,并且提高硝酸的氧化性 | |
| D. | 将浓硫酸滴入浓盐酸中制备HCl气体.浓盐酸作用:增大溶质的浓度,有利于促进平衡向气体溶解的逆方向移动 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com