
����Ŀ����ͼ��ʾװ���У��ס��ҡ��������ձ����ηֱ�ʢ��100 g 5.00%��NaOH��Һ��������CuSO4��Һ��100 g 10.00%��K2SO4��Һ���缫��Ϊʯī�缫��
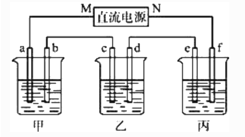
��ͨ��Դ������һ��ʱ���ñ���K2SO4������������Ϊ10.47%������c�缫�������ӡ�
�ٵ�Դ��N��Ϊ________����
�ڵ缫b�Ϸ����ĵ缫��ӦʽΪ___________________________________________��
�۵缫b�����ɵ������ڱ�״���µ����___________L��
�ܵ缫c�������仯��________g��
�ݵ��ǰ����Һ��pH���ֲ������________��
A������Һ B������Һ C������Һ
���𰸡� �� 4OH��-4e��=2H2O��O2�� 2.8 16 C
����������1��c�缫������������Ϊͭ���ӵõ������ɵ���ͭ�������ڵ缫���棬����c�缫һ��Ϊ�����������Ӷ��Ʋ����MΪ������NΪ������
��2��bΪ�������������Һ������������Ӧ����������ʧ����������������4OH��-4e��=2H2O��O2��
��3�����е��K2SO4����Һʵ���൱�ڵ��ˮ��ˮ����ʹ��Һ������������10%���ߵ�10.47%��ԭ����100 g 10.00%��K2SO4��Һ�к��������10g����Ӧ����Һ����Ϊ10��10.47% = 95.51g�����Լ��ٵ�ˮΪ100-95.51=4.49g������Ӧ��ˮԼΪ0.25mol�����ݵ��ˮ�ķ�Ӧ��ת�Ƶ���Ϊ0.5mol������ÿ���缫��ת�Ƶĵ��Ӷ���0.5mol������b�缫�ķ�Ӧ����ʽ���ɼ�������ɵ�����Ϊ0.125mol���Ϊ2.8L��
��4��c�缫�ķ�Ӧ��Cu2+ + 2e- = Cu��ת��0.5mol���ӣ�����0.25molCu����Ϊ16g��
��5����Ϊ����������Һ�����ʱ�൱�ڵ��ˮ������ˮ�ļ��٣���������Ũ�����ӣ�pH������Ϊ����ͭ��Һ�����ķ�ӦΪ2CuSO4 + 2H2O![]() 2Cu + O2��+ 2H2SO4��������Һ��pH��С����Ϊ�������Һ�����������൱�ڵ��ˮ�����Dz���Ũ����α仯��������վ������Եģ�pH=7�����ֲ��䡣��Ϊ����
2Cu + O2��+ 2H2SO4��������Һ��pH��С����Ϊ�������Һ�����������൱�ڵ��ˮ�����Dz���Ũ����α仯��������վ������Եģ�pH=7�����ֲ��䡣��Ϊ����


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������Լ���ʢװ�ڲ������Լ�ƿ�е���
A. ���� B. ����� C. ˮ���� D. KOH��Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������һ����Ҫ�Ļ���ԭ�ϣ��ڹ�ũҵ������������������Ҫ��Ӧ�ã����������ѧ֪ʶ�ش��������⣺
��1������������ͨ����ɫʯ����Һ�У����Թ۲쵽�������ǣ� �� ����������е�ԭ�� ��
��2����ij��ѧ��ȤС��ƻ�������������������ȡ��������Һ�����䷴Ӧԭ��Ϊ�����û�ѧ����ʽ��ʾ�� ��
��ʵ�������ƺ�4.0molL��1��NaOH��Һ��������ҺmL������2.24L��������״����ǡ����ȫ��Ӧ��
������250mL 4.0molL��1 NaOH��Һ��ʵ�鲽�裺
a��������Ҫ�������ƹ��������
b�������������ƹ���
c�����ձ��е���Һע������ƿ��������������ˮϴ���ձ��ڱ�2��3�Σ�ϴ��ҺҲע������ƿ��
d������������ˮ�ܽ�����õ��������ƹ��壬������ȴ��
e���Ǻ�ƿ�����������µߵ���ҡ�ȣ�
f������������ƿ�м�����ˮ���̶�����1cm��2cmʱ�����ý�ͷ�ιܼ�����ˮ����Һ����̶������У�
������ƽ�����������������ƹ����������g��
�������������ȷ����˳���� ��
������ʵ����Ҫ�IJ��������� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ˮϡ��0.1mol/L��ˮʱ����Һ������ˮ�������Ӷ���С����( )
A. c��OH-��/c��NH3��H2O�� B. n��OH-��
C. c��NH3��H2O��/c��OH-�� D. c��H����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1���ڴ���CuSO4��5H2O�����г���������Fe2+�����ᴿʱΪ�˳�ȥFe2+�������������������ʹFe2+����ΪFe3+���������ʿɲ��õ���________
A. KMnO4 �� B. H2O2 ���� C. Cl2 ˮ ���� D. HNO3
Ȼ���ټ����ʵ����ʵ�������ҺpH=3.8��ʹFe3+ת��ΪFe(OH)3�����Դﵽ��ȥFe3+������ʧCuSO4��Ŀ�ģ�������ҺpH��ѡ�������е�________
A. NaOH B. NH3��H2O C. CuO D. Cu(OH)2
��2����ͬѧ���ɵ�������ҺpH=4�Ƿ��ܴﵽ��ȥFe3+������ʧCu2+��Ŀ�ģ���ͬѧ��Ϊ����ͨ������ȷ��,��֪lg2=0.3��������Fe(OH)3���ܶȻ�Ksp=8.0��10-38,Cu(OH)2���ܶȻ�Ksp=3.0��10-20��ͨ����Ϊ��������Һ�е�����Ũ��С��1��10-5 mol��L-1ʱ����Ϊ������ȫ������Һ��CuSO4��Ũ��Ϊ3.0 mol��L-1����Cu(OH)2��ʼ����ʱ��Һ��pHΪ____��Fe3+��ȫ����ʱ��Һ��pHΪ____��ͨ������ȷ����������________��������������������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʲ���ͨ�����Ϸ�Ӧ�õ�����
A. Al(OH)3 B. Fe (OH)3 C. Fe3O4 D. FeS
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������NaHCO3��Na2CO3xH2O�Ļ����7.4g�����ȵ���Ӧ��ȫ�����ò������������α���ˮ�Ȼ���B�ͼ�ʯ��C��ȫ���գ���ȴ������ʱ�����B������3.78g��C������0.44g���������������⣺
��1����������ijɷ��� �� ������g��
��2��ԭ�������NaHCO3��������g��
��3�����x��ֵ��Ҫ���м�����̣�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��X Ԫ������������ˮ���ﻯѧʽΪ H2XO4���� X����̬�⻯��Ļ�ѧʽΪ
A. XH4 B. XH3 C. H2X D. HX
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������Σ���FeCl3 ��CH3COONa ��NaCl����ˮ��Һ��pH�ɴ�С������ȷ���ǣ� ��
A.�٣��ۣ���
B.�ڣ��ۣ���
C.�ۣ��ڣ���
D.�٣��ڣ���
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com