
| A. | 含0.1molHCl溶液中含氢元素0.1NA | |
| B. | 22.4 L 水蒸气含原子数为3NA | |
| C. | 3.4g H2O2中含有的共用电子对数为0.1 NA | |
| D. | 标准状况下,1mol辛烷含有的氢原子数为18NA |
分析 A.HCl溶液中,氯化氢和水分子都含有氢元素;
B.气体状况未知,气体摩尔体积未知;
C.质量转化为物质的量,结合1molH2O2中存在3mol共用电子对数来分析;
D.辛烷的分子式为C8H18.
解答 解:A.含0.1molHCl溶液中含氢元素大于0.1NA,故A错误;
B.气体状况未知,气体摩尔体积未知,无法计算水蒸气物质的量和所含有原子个数,故B错误;
C.过氧化氢的物质的量为$\frac{3.4g}{34g/mol}$=0.1mol,1molH2O2中存在3mol共用电子对数,则3.4gH2O2中含有的共用电子对数为0.3NA,故C错误;
D.辛烷的分子式为C8H18,所以1个辛烷分子中含有8个氢原子,故D正确;
故选:D.
点评 本题考查有关物质的量及阿伏伽德罗常数的计算,明确质量、体积、微观粒子数、物质的量的关系是解答的关键,注意气体摩尔体积使用条件和对象.


 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:解答题
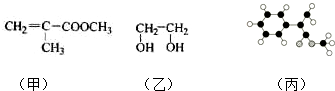

 ;
;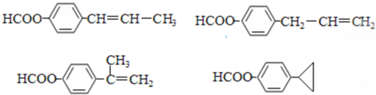 (只写一种即可)
(只写一种即可)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 30 g乙烷中所含的极性共价键数为7NA | |
| B. | 标准状况下,22.4 L N2和CO2混合气体所含的分子数为2NA | |
| C. | 已知N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol,则NA个N2分子与足量氢气充分反应释放热量92.4kJ | |
| D. | Na2O2与CO2反应生成1 molO2时,转移的电子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
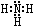 ;B分子也由Z、X两元素组成,作为运送飞船的火箭燃料,常温下是一种液态化合物.已知该化合物的相对分子质量为32,其中X元素的质量分数为12.5%,且该分子结构中只有单键.则B的结构式为
;B分子也由Z、X两元素组成,作为运送飞船的火箭燃料,常温下是一种液态化合物.已知该化合物的相对分子质量为32,其中X元素的质量分数为12.5%,且该分子结构中只有单键.则B的结构式为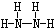 .若64g B分子与液态双氧水恰好完全反应,产生两种无毒又不污染环境的气态物质,还放出3000kJ的热量,写出该反应的热化学方程式N2H4(l)+2H2O2(l)=N2(g)+4H2O(g)△H=-1500kJ/mol.
.若64g B分子与液态双氧水恰好完全反应,产生两种无毒又不污染环境的气态物质,还放出3000kJ的热量,写出该反应的热化学方程式N2H4(l)+2H2O2(l)=N2(g)+4H2O(g)△H=-1500kJ/mol.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
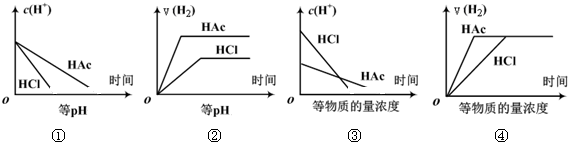
| A. | ①③ | B. | ②④ | C. | ①②③ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
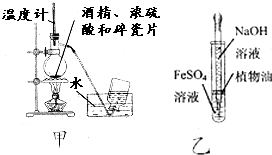
| A. | 为测定熔融氢氧化钠的导电性,可在瓷坩埚中熔化氢氧化钠固体 | |
| B. | 用甲图装置制取乙烯 | |
| C. | 用乙图装置制备少量氢氧化亚铁 | |
| D. | 加入适量乙醇和浓硫酸,加热,可除去乙酸乙酯中少量的乙酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | M=WNA | B. | M=$\frac{16w}{b}$ | C. | M=$\frac{w}{16b}$ | D. | M=$\frac{w}{{N}_{A}}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
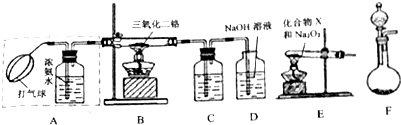
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com