
 某温度时,AgCl(s)?Ag+(aq)+Cl-(aq)在水中的沉淀溶解平衡曲线如图所示.下列说法正确的是( )
某温度时,AgCl(s)?Ag+(aq)+Cl-(aq)在水中的沉淀溶解平衡曲线如图所示.下列说法正确的是( )| A. | 加入AgNO3,可以使溶液由c点变到d点 | |
| B. | 加入少量水,平衡右移,Cl-浓度减小 | |
| C. | d点没有AgCl沉淀生成 | |
| D. | c点对应的Ksp等于a点对应的Ksp |
分析 A.加入AgNO3,c(Ag+)增大,c(Cl-)减小;
B.溶液存在溶解平衡,加入少量水,促进溶解,如认为饱和溶液,则离子浓度不变;
C.d点处银离子浓度大,此时银离子浓度和氯离子浓度乘积大于溶度积常数;
D.温度一定溶度积常数不变.
解答 解:A.加入AgNO3固体,银离子浓度增大,氯离子浓度减小,而cd点氯离子浓度相同,故A错误;
B.溶液存在溶解平衡,加入少量水,促进溶解,如认为饱和溶液,则离子浓度不变,故B错误;
C.d点处银离子浓度大,此时银离子浓度和氯离子浓度乘积大于溶度积常数,有氯化银沉淀生成,故C错误;
D.温度不变Ksp不变,ac点是相同温度下的溶解沉淀平衡,Ksp相同,故D正确;
故选D.
点评 本题考查沉淀溶解平衡,题目难度中等,注意理解难溶电解质在水中的沉淀溶解平衡特点,正确理解和掌握溶度积KSP的概念.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
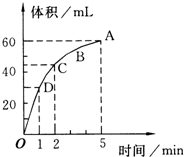 加入0.1mol的MnO2粉末于50mL过氧化氢的溶液中,在标准状况下放出气体的体积和时间的关系如图所示(5分钟反应完成),回答下列问题:
加入0.1mol的MnO2粉末于50mL过氧化氢的溶液中,在标准状况下放出气体的体积和时间的关系如图所示(5分钟反应完成),回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
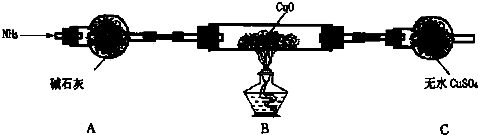
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化硅在电子工业中,是最重要的半导体材料 | |
| B. | 硅是构成矿物和岩石的主要元素,硅在地壳中的含量在所有的元素中居第一位 | |
| C. | 硅的化学性质不活泼,在自然界中可以以游离态存在 | |
| D. | 光导纤维是以二氧化硅为主要原料制成的 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 醋酸跟氢氧化钠溶液反应:CH3COOH+OH-→CH3COO-+H2O | |
| B. | 铁跟稀盐酸反应:Fe+2H+→Fe2++H2↑ | |
| C. | 在硫氢化钠溶液中加入稀硫酸溶液:S2-+2H+→H2S↑ | |
| D. | 碳酸钙溶于盐酸中:CaCO3+2H+→Ca2++H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 电解饱和食盐水制烧碱采用离子交换膜法,可以阻止阳离子通过 | |
| B. | 在铁上镀锌时,锌棒作阳极,且电解液硫酸锌的浓度是不变的 | |
| C. | 用惰性电极电解Na2SO4溶液,阴阳两极产物的物质的量之比为1:2 | |
| D. | 用惰性电极电解饱和NaCl溶液,若有1 mol电子转移,则生成1 molNaOH |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com