
【题目】将下列各组物质按酸、碱、盐分类顺序排列,正确的是( )
A.H2SO4 Na2CO3 Ca(OH)2
B.HCl NaOH K2CO3
C.H2CO3 C2H5OH NaHSO4
D.Ba(OH)2 H3PO4 KOH
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】两种一元碱MOH和ROH的溶液分别加水稀释,溶液pH的变化如图所示,下列叙述不正确的是

A.MOH是一种弱碱
B.在x点,c(M+)=c(R+)
C.稀释前,c(ROH)=10 c(MOH)
D.稀释前MOH溶液和ROH溶液中由水电离出的c(OH﹣)后者是前者的 10倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组拟用定量的方法测量Al和Fe分别与酸反应的快慢,设计了如图1所示的装置。
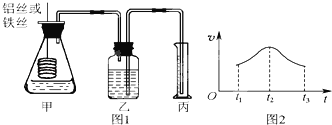
(1)检查图1所示装置气密性的方法是 。
(2)若要比较产生气体的快慢,可以测量相同时间段内产生气体的体积,也可以测量 。
(3)实验测得铝丝产生气体的速率(v)与时间(t)的关系如图2所示,则t1~t2时间段内反应速率逐渐加快的主要原因是 ;t2~t3时间段内反应速率逐渐减慢的主要原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A是烃的含氧衍生物,在同温同压下,A蒸气与乙醇蒸气的相对密度是2。1.38g A完全燃烧后,若将燃烧的产物通过碱石灰,碱石灰的质量会增加3.06g;若将燃烧产物通过浓硫酸,浓硫酸的质量会增加1.08g;通过计算确定A的分子式(写出必要的文字说明、计算过程)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚对苯二甲酸乙二酯(J)具有良好的力学性能,其薄膜的伸拉强度是聚乙烯薄膜的9倍。它的合成路线如下:
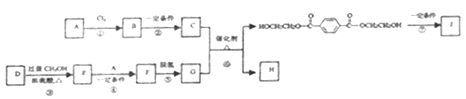
已知:
①![]()
②酯与醇可发生如下酯交换反应:RCOOR′+R〞OH ![]() RCOOR〞+R′OH(R、R′、R〞代表烃基)
RCOOR〞+R′OH(R、R′、R〞代表烃基)
(1)A的产量标志着一个国家石油化工发展水平,反应①的反应类型为______________。
(2)C的分子式是C2H6O2,是汽车防冻液的主要成分。反应②的试剂和反应条件是____________。
(3)D的分子式是C6H6O4,是一种直链结构的分子,核磁共振氢谱有3种峰,D种含有的官能团是______。
(4)F的结构简式是__________________。
(5)反应⑥的化学方程式是_________________。
(6)反应⑦为缩聚反应,反应⑦的化学方程式是_________________。
(7)G是一种同分异构体,G′为甲酸酯,核磁共振氢谱有3种峰且1mol该有机物酸性条件下水解产物能与2molNaOH反应。G′的结构简式为______________。
(8)以对二甲苯、甲醇为起始原料,选用必要的无机试剂合成G,写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下充满HCl的烧瓶做完喷泉实验后得到稀盐酸,用标准碳酸钠溶液滴定这种盐酸测定它的准确浓度,请你回答下列问题:
(1)用标准Na2CO3溶液滴定这种盐酸时,Na2CO3溶液应装在_______式滴定管内,原因是(文字叙述并用有关离子方程式表示): ;若用甲基橙作指示剂,达到滴定终点时,溶液从_______色变为_______色。
(2)现配制三种浓度的标准Na2CO3溶液,你认为最合适的是下列第______种(填序号)。
①2.500 mol/L ②0.25 mol/L ③0.025mol/L
(3)若采用上述合适浓度的标准Na2CO3溶液滴定,用C(Na2CO3)表示,滴定时实验数据列表如下:
实验编号 | 待测盐酸体积(mL) | 滴入Na2CO3溶液体积(mL) |
1 | 20.00 | 18.80 |
2 | 20.00 | 16.95 |
3 | 20.00 | 17.05 |
根据以上数据计算时应带入的Na2CO3溶液体积为_________,求这种待测盐酸的物质的量浓度(用数据和符号列式即可):C(HCl)=_________ 。
(4)若盛装Na2CO3溶液的滴定管在滴定前未用标准液润洗,则最后所测盐酸浓度______(填“偏高”、“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)从能量的变化和反应的快慢等角度研究反应:2H2 + O2 = 2H2O。 已知该反应为放热反应,下图能正确表示该反应中能量变化的是________。(填“A”或“B”)
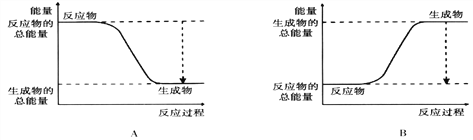
从断键和成键的角度分析上述反应中能量的变化。化学键的键能如下表:
化学键 | H—H | O=O | H—O |
键能kJ/mol | 436 | 496 | 463 |
则生成1mol水可以放出热量 _____kJ
(2)以下反应:①木炭与水制备水煤气 ②氯酸钾分解 ③炸药爆炸 ④酸与碱的中和反应 ⑤生石灰与水作用制熟石灰 ⑥ Ba(OH)2·8H2O与NH4Cl ⑦气态水液化,属于放热反应的有:
_________________(填序号),写出反应⑥的化学方程式________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以芳香烃A为原料合成有机物F和I的合成路线如下:
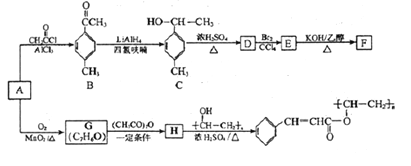
(1)A的分子式为__________,C中的官能团名称为________________。
(2)D分子中最多有______个原子共平面。
(3)E生成F的反应类型为___________,G的结构简式为__________。
(4)由H生成I的化学方程式为______________。
(5)符合下列条件的B的同分异构体有_______种(不考虑立体异构),其中核磁共振氢谱为4组峰,且面积比为6:2:1:1的是________(写出其中一种的结构简式)。
①属于芳香化合物; ②能发生银镜反应。
(6)已知![]() ,参照上述合成路线,以苯和丙酸为原料(无机试剂任选),设计制备
,参照上述合成路线,以苯和丙酸为原料(无机试剂任选),设计制备![]() 的合成路线________________。
的合成路线________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2作为一种广谱型的消毒剂,将逐渐用来取代Cl2成为自来水的消毒剂。已知ClO2是一种易溶于水而难溶于有机溶剂的气体,实验室制备ClO2的原理是用亚氯酸钠固体与氯气反应 :2NaClO2 + Cl2 ===2ClO2 + 2NaCl。
下图是实验室用于制备和收集一定量较纯净的ClO2的装置(某些夹持装置和垫持用品省略)。其中E中盛有CCl4液体(用于除去ClO2中的未反应的Cl2)。
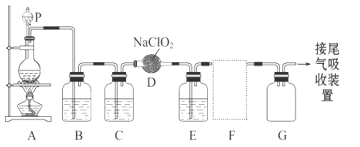
(1)仪器P的名称是______________________。
(2)写出装置A中烧瓶内发生反应的离子方程式:_____________________。
(3)B装置中所盛试剂是____________________。
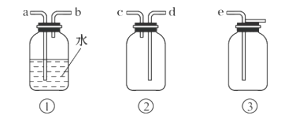
(4)F为ClO2收集装置,应选用的装置是______________(填序号),其中与E装置导管相连的导管口是__________(填接口字母)。
(5)若用100 mL 2 mol·L-1的浓盐酸与足量的MnO2制备Cl2,则被氧化的HCl的物质的量是________(填序号)。
A.>0.1 mol B.0.1 mol C.<0.1 mol D.无法判断
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com