
| A. | 原子序数为34 | B. | 还原性:H2Se<H2S | ||
| C. | 酸性:H2SeO4<HBrO4 | D. | Se氧化物化学式有:SeO2、SeO3 |
分析 A.硒是第四周期ⅥA元素,与S元素原子序数相差第四周期容纳元素种数;
B.同主族上而下非金属性减弱,非金属性越强,氢化物还原性越弱;
C.非金属性越强,最高价含氧酸的酸性越强;
D.Se与S元素性质相似.
解答 解:A.硒是第四周期ⅥA元素,与S元素原子序数相差第四周期容纳元素种数,其原子序数为16+18=34,故A正确;
B.同主族上而下非金属性减弱,非金属性越强,氢化物还原性越弱,故还原性:H2Se>H2S,故B错误;
C.非金属性Br>Se,非金属性越强,最高价含氧酸的酸性越强,故酸性:H2SeO4<HBrO4,故C正确;
D.Se与S元素性质相似,Se氧化物化学式有:SeO2、SeO3,故D正确,
故选B.
点评 本题考查元素周期表和元素周期律,明确元素的位置和性质的关系及同主族性质变化规律即可解答,难度不大.


 互动英语系列答案
互动英语系列答案科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,1L辛烷完全燃烧所生成的气态产物的分子数为$\frac{8{N}_{A}}{22.4}$ | |
| B. | 1 mol羟基(-OH)所含的电子总数为7NA | |
| C. | 0.5mol 丙烯醛(CH2=CH-CHO)与足量银氨溶液反应,转移的电子数为2NA | |
| D. | 1 mol碳正离子(CH+3)所含的电子总数为8NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
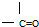 ②
②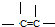 ③
③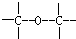 ④
④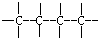
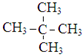
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知常温下AgCl的溶解度远大于AgBr,现将AgCl和AgBr的两种饱和溶液等体积混合后,再加入足量浓AgNO3溶液,生成的AgCl沉淀多于AgBr沉淀 | |
| B. | Fe(OH)3溶于氢碘酸的离子方程式为:Fe(OH)3+3H+=Fe3++3H2O | |
| C. | 甲基橙呈黄色的溶液中,I-、Cl-、NO3-、Na+一定可以大量共存 | |
| D. | 已知甲烷的燃烧热为890.3kJ•mol-1,则表示甲烷燃烧热的热化学方程式为: CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4Br的电子式: | |
| B. | S2-的结构示意图: | |
| C. | 氚表示为:${\;}_{1}^{2}$D | |
| D. | 原子核内有l8个中子的氯原子:${\;}_{17}^{36}$Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 烯类化合物 | 相对速率 |
| (CH3)2C=CHCH3 | 10.4 |
| CH3CH=CH2 | 2.03 |
| CH2=CH2 | 1.00 |
| CH2=CHBr | 0.04 |
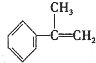 与HBr反应的主要产物的结构简式
与HBr反应的主要产物的结构简式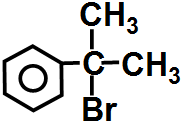 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 容器内气体C的物质的量不再改变 | |
| B. | 容器内混合气体的A、B、C的浓度之比为1:3:2 | |
| C. | 单位时间内生成 n mol的A,同时消耗2n mol的C | |
| D. | 正、逆反应均不再进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com