
【题目】已知A、B为常见的浓酸溶液;X、Y、Z、W均为氧化物,其中X是红棕色气体,Y的固体可用于人工降雨,W既能使澄清石灰水变浑浊,又能使品红溶液褪色。根据如图所示转化关系(反应条件略),回答下列问题:
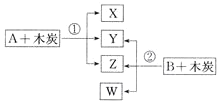
(1)Y是__________(填化学式)。
(2)将B露置在空气中一段时间,溶液质量增加但溶液浓度降低,表明B具有_____性;利用这种性质可以进行______(填字母)实验操作。
![]() 干燥二氧化硫
干燥二氧化硫 ![]() 检验
检验![]() c 干燥氨气
c 干燥氨气 ![]() 钝化铝片
钝化铝片
(3)写出X与Z的反应方程式:________________。
(4)W具有漂白性,氯水也有漂白性,两者同时使用,漂白效果将_________(填“增强”或“减弱”),原因是____________(用化学方程式表示)。
(5)反应①中氧化产物和还原产物的物质的量之比为____。
【答案】CO2 吸水 a 3NO2+H2O=2HNO3+NO 减弱 SO2+Cl2+2H2O=H2SO4+2HCl 1:4
【解析】
X是红棕色气体,应为NO2,Y的固体可用于人工降雨,应为CO2,则A为浓硝酸,Z为H2O,W既能使澄清石灰水变浑浊,又能使品红溶液褪色,应为SO2,由转化关系可知B为浓硫酸,以此解答该题。
(1)由以上分析可知Y为CO2;
(2)将浓硫酸露置在空气中一段时间,溶液质量增加但溶液浓度降低,表明浓硫酸具有吸水性,利用这种性质可用于干燥气体,但不能干燥碱性气体,故答案选a;
(3)二氧化氮与水反应生成硝酸和NO,反应的方程式为3NO2+H2O=2HNO3+NO;
(4)氯气和二氧化硫发生氧化还原反应生成盐酸和硫酸,方程式为反应方程式为:SO2+Cl2+2H2O=H2SO4+2HCl,导致漂白效果减弱;
(5)反应①为C+4HNO3(浓)![]() CO2↑+4NO2↑+2H2O,由方程式可知氧化产物和还原产物的物质的量之比为1:4。
CO2↑+4NO2↑+2H2O,由方程式可知氧化产物和还原产物的物质的量之比为1:4。


科目:高中化学 来源: 题型:
【题目】CO2是一种主要的温室气体,研究CO2的利用对促进低碳社会的构建具有重要的意义。
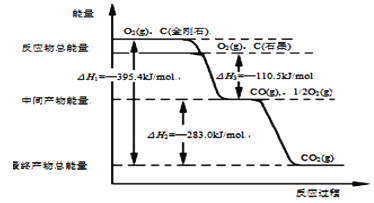
(1)金刚石和石墨燃烧反应中的能量变化如图所示。在通常状况下,金刚石和石墨中,__(填“金刚石”或“石墨”)更稳定,石墨的燃烧热ΔH为___。
(2)采用电化学法可将二氧化碳转化为甲烷,试写出以氢氧化钾水溶液作电解质溶液时,该转化的电极反应式为___。
(3)以CO2为原料还可以合成多种物质。工业上常以CO2(g)与H2(g)为原料合成乙醇。
①已知:H2O(l)=H2O(g) △H=+44kJ·mol-1
CO(g)+H2O(g)![]() CO2(g)+H2(g) △H=-41.2kJ·mol-1
CO2(g)+H2(g) △H=-41.2kJ·mol-1
2CO(g)+4H2(g)![]() CH3CH2OH(g)+H2O(g) △H=-256.1kJ·mol-1
CH3CH2OH(g)+H2O(g) △H=-256.1kJ·mol-1
则:CO2气体与氢气反应生成气态乙醇和液态水的热化学方程式为___。
②如图是一种以烟道气为原料合成乙醇的工作原理示意图。对该流程的分析,下列说法正确的是___。

A.该流程至少包含4种形式的能量转化
B.装置X中为了增强水的导电性,通常向其中加入少量Na2SO4或NaOH
C.合成塔中生成乙醇的反应是化合反应
D.流程设计体现了绿色化学思想
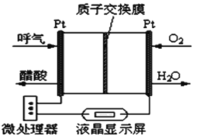
③如图所示是一种酸性燃料电池酒精检测仪,具有自动吹气流量侦测与控制的功能,非常适合进行现场酒精检测。该电池负极的电极反应式为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中含有以下离子中的若干种:K+、Cl-、NH、Mg2+、CO![]() 、Ba2+、SO
、Ba2+、SO![]() 。现取3份该溶液各100 mL分别进行如下实验:
。现取3份该溶液各100 mL分别进行如下实验:
实验序号 | 实验内容 | 实验结果 |
① | 加AgNO3溶液 | 有白色沉淀生成 |
② | 加足量NaOH溶液并加热 | 收集到气体,在标准状况下体积为2.24 L |
③ | 加足量BaCl2溶液,对所得沉淀进行洗涤、干燥、称量;再向沉淀中加足量稀盐酸,然后干燥、称量 | 第一次称量读数为12.54 g,第二次称量读数为4.66g |
试回答下列问题:
(1)根据实验①对Cl-是否存在的判断是_______________(填“一定存在”“一定不存在”或“不能确定”);根据实验①~③判断混合物中一定不存在的离子是___________。
(2)试确定溶液中一定存在的阴离子及其物质的量浓度(可不填满):
阴离子符号 | 物质的量浓度(mol/L) |
__________ | |
(3)试确定K+是否存在 __________ (填“是”或“否”),判断的理是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化氢(H2O2)的水溶液俗称双氧水。双氧水常被称为化学反应中的“绿色试剂”。已知,在含少量I-的溶液中,H2O2会较快分解,反应如下:反应①:H2O2+I- → H2O+IO-; 反应②:H2O2+IO- → H2O+O2+I-,完成下列填空:
(1)反应①中的氧化产物是_________,被还原的元素是___________。
(2)标出反应②中电子转移的方向和数目。_______________
(3)H2O2分解过程中,I-的作用是__________。
(4)根据反应①和反应②,请说明双氧水被称为“绿色试剂”的主要原因是_____。
(5)H2O2是一种二元弱酸,写出第一步电离的电离方程式:________,双氧水可漂白纤维织物,目前认为是其中过氧化氢离子(HOO-)的作用。为了增强其漂白效果,应选择在____(填“酸”、“碱”或“中”)性条件下进行。
(6)向盐酸酸化的FeCl2溶液中加入双氧水,溶液由浅绿色变为棕黄色,写出该变化的化学反应方程式:_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为测定某硬铝(含有铝、镁、铜)中铝的含量,设计了Ⅰ、Ⅱ两个方案。根据方案Ⅰ、Ⅱ回答问题:
方案Ⅰ:
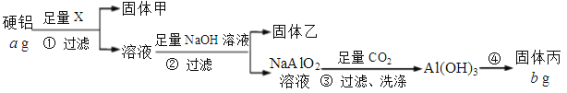
(1)固体甲是铜,试剂X的名称是_______________。
(2)能确认NaOH溶液过量的是___________(选填选项)。
a. 测溶液pH,呈碱性
b. 取样,继续滴加NaOH溶液,不再有沉淀生成
c. 继续加NaOH溶液,沉淀不再有变化
(3)步骤④的具体操作是:灼烧、_______、________,重复上述步骤至恒重。
(4)固体丙的化学式是______,该硬铝中铝的质量分数为_______________。
方案Ⅱ的装置如图所示:
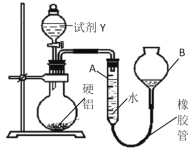
操作步骤有:
①记录A的液面位置;
②待烧瓶中不再有气体产生并恢复至室温后,使A和B液面相平;
③再次记录A的液面位置;
④将一定量Y(足量)加入烧瓶中;
⑤检验气密性,将a g硬铝和水装入仪器中,连接好装置。
(1)试剂Y是________________;操作顺序是______________________。
(2)硬铝质量为a g,若不测气体的体积,改测另一物理量也能计算出铝的质量分数,需要测定的是_______,操作的方法是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数,下列说法中正确的是
A.46gNO2和N2O4的混合气体中含有的原子个数为3NA
B.常温常压下,17gNH3含有NA个N-H共价键
C.1molFe与S恰好完全反应,转移的电子数为3NA
D.标况下,2.24LH2O含有的质子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
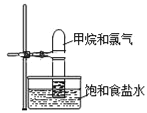
【题目】将如图装置放置在光亮的地方,随后观察到如下实验现象:大试管内壁上有油状液滴生成、饱和食盐水中有少量固体析出、黄绿色气体颜色变浅、试管内液面有所上升。
(1)油状液滴的成分可能是CCl4和___。
(2)水槽中盛放饱和食盐水而不是蒸馏水是为了抑制___与水的反应。
(3)试管内液面上升的原因是___极易溶于水。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水综合利用要符合可持续发展的原则,其联合工业体系(部分)如图所示,下列说法错误的是
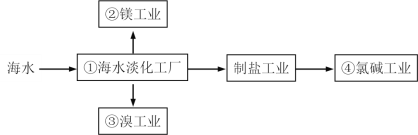
A.①中可采用蒸馏法B.②中可通过电解法制金属镁
C.③中提溴涉及到复分解反应D.④的产品可生产盐酸、漂白液等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汉黄芩素是传统中草药黄芩的有效成分之一,对肿瘤细胞的杀伤有独特作用。下列有关汉黄芩素的叙述正确的是
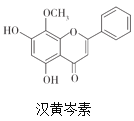
A. 能与Na2CO3溶液反应放出气体
B. 该物质遇FeCl3溶液不显色
C. 1mol该物质与溴水反应,最多消耗2molBr2
D. 与足量H2发生加成反应后,该分子中官能团的种类减少1种
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com