
| A.若为盐酸溶液,pH减小 |
| B.若为氢氧化钠溶液,pH减小 |
| C.若为硫酸钠溶液,pH不变 |
| D.若为氯化钠溶液,pH不变 |
科目:高中化学 来源:不详 题型:计算题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| | NaOH的质量分数 | 阳极析出物的质量/g | 阴极析出物的质量/g |
| A | 0.062(6.2%) | 19 | 152 |
| B | 0.062(6.2%) | 152 | 19 |
| C | 0.042(4.2%) | 1.2 | 9.4 |
| D | 0.042(4.2%) | 9.4 | 1.2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
| 时间/min | 0 | 10 | 20 | 30 | 60 |
| pH | 4 | 3 | 2 | 1 | 1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.阳极的电极反应式为:2Cl-→Cl2↑+2e- |
| B.阴极的电极反应式为:TiO2+4e-→Ti+2O2- |
| C.通电后,O2-、Cl-均向阴极移动 |
| D.石墨电极的质量不发生变化 |
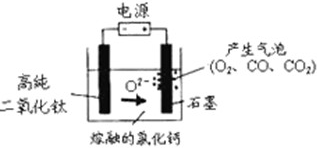
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.电解池的阳极上发生氧化反应,阴极上发生还原反应 |
| B.原电池跟电解池连接后,电子从电池负极流向电解池阳极 |
| C.电镀时,电镀池里的阳极材料发生氧化反应 |
| D.电解饱和食盐水时,阴极得到氢氧化钠溶液和氢气 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
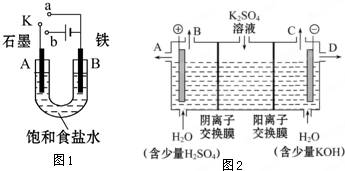
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.4:1 | B.3:1 | C.2:1 | D.1:1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
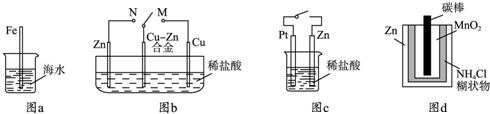
| A.图a中,插入海水中的铁棒,越靠近底端腐蚀越严重 |
| B.图b中,开关由M改置于N时,Cu﹣Zn合金的腐蚀速率减小 |
| C.图c中,接通开关时Zn腐蚀速率增大,Zn上放出气体的速率也增大 |
| D.图d中,Zn﹣MnO2干电池自放电腐蚀主要是由MnO2的氧化作用引起的 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com