
| A. | 金属钠着火时使用泡沫灭火器灭火 | |
| B. | 明矾常用于水体的净化、杀菌和消毒 | |
| C. | 热的纯碱溶液去污效果更好 | |
| D. | 84消毒液与洁厕灵混合后用于清洁洗手间的效果更好 |
分析 A.金属钠着火生成过氧化钠,与泡沫灭火器喷出的二氧化碳反应;
B、明矾净水是氢氧化铝只能净水,无消毒作用;
C、升高温度促进碳酸根水解;
D、盐酸与次氯酸反应生成氯气;
解答 解:A.金属钠着火生成过氧化钠,与泡沫灭火器喷出的二氧化碳反应,反应生成的氧气助燃,不能灭火,应利用沙土铺盖,故A错误;
B、明矾净水是氢氧化铝只能净水,无消毒作用,故B错误;
C、碳酸根水解CO32-+H2O?HCO3-+OH-,溶液呈碱性,水解过程是吸热过程,升高温度促进碳酸根水解,碱性增强,去油污能力增强,故C正确;
D、洁厕灵(有效成分为HCl)与84消毒液(有效成分为NaClO)混合使用发生氧化还原反应生成氯气,容易引起中毒,故D错误;
故选C.
点评 本题考查了元素化合物知识,明确金属钠、明矾的净水、盐的水解等是解题关键,题目难度不大.


科目:高中化学 来源: 题型:解答题
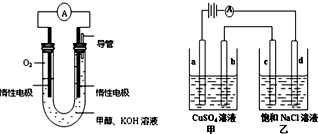
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
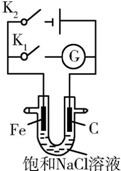
| A. | K1闭合,铁棒上发生的反应为2H++2e-═H2↑ | |
| B. | K1闭合,石墨棒周围溶液的pH逐渐降低 | |
| C. | K2闭合,铁棒不会被腐蚀,属于牺牲阳极的阴极保护法 | |
| D. | K2闭合,电路中通过0.002NA个电子时,两极共产生0.002 mol气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
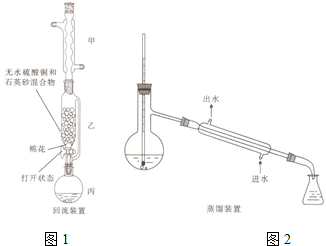 苯甲酸(
苯甲酸(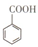 )和乙醇在浓硫酸催化下可以制得苯甲酸乙酯,及时除去反应中产生的水可提高酯的产率.据此某实验小组设计了如下图的装置来进行上述实验.相关信息如下:
)和乙醇在浓硫酸催化下可以制得苯甲酸乙酯,及时除去反应中产生的水可提高酯的产率.据此某实验小组设计了如下图的装置来进行上述实验.相关信息如下:| 相对分子质量 | 密度/(g•cm-3) | 沸点/℃ | 水中溶解度 | |
| 苯甲酸 | 122 | 1.27 | 249 | 微溶 |
| 乙醇 | 46 | 0.789 | 78.3 | 易溶 |
| 苯甲酸乙酯 | 150 | 1.05 | 212.6 | 难溶 |
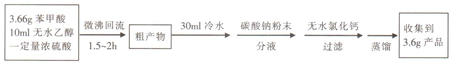
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属在反应中只能作还原剂,非金属在反应中只能作氧化剂 | |
| B. | 氧化剂在反应中失去电子,还原剂在反应中得到电子 | |
| C. | 金属离子在反应中可能被氧化、也可能被还原 | |
| D. | 阳离子只有氧化性,阴离子只有还原性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使酚酞变红色的溶液中:Na+、Al3+、SO42-、Cl- | |
| B. | 与Fe反应能放出H2的溶液中:Fe2+、K+、NO3-、SO42- | |
| C. | $\frac{{K}_{W}}{c({H}^{+})}$=1×10-13mol•L-1的溶液中:NH4+、Ca2+、Cl-、NO3- | |
| D. | 水电离的c(H+)=1×10-13mol•L-1的溶液中:K+、Na+、AlO2-、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4 L H2O含有的分子数为 NA | |
| B. | 28g N2和N4组成的混合气体中含有的原子数为2 NA | |
| C. | 1 mol•L-1A1Cl3溶液中含有的Cl-数目为3 NA | |
| D. | 2.3 g Na与足量水反应,转移的电子数目为0.2 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 0.1mol•L-1(NH4)2Fe(SO4)2溶液中;c(NH4+)+c(NH3•H2O)+c(Fe2+)=0.3mol•L-1 | |
| B. | 常温下,pH=6的NaHSO3溶液中:c(SO32-)-c(H2SO3)=9.9×10-7mol•L-1 | |
| C. | NH4HSO3溶液中滴加NaOH至溶液恰好呈中性:c(Na+)>c(SO42-)=c(NH4+)>c(OH-)=c(H+) | |
| D. | 等浓度、等体积的Na2CO3和NaHCO3混合:$\frac{c(HC{{O}_{3}}^{-})}{c({H}_{2}C{O}_{3})}$>$\frac{c(C{{O}_{3}}^{2-})}{c(HC{{O}_{3}}^{-})}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
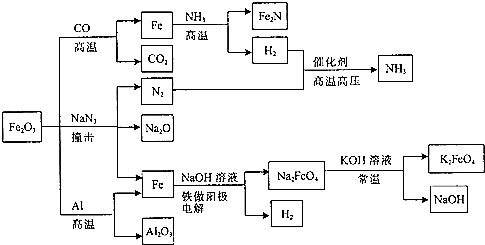
| A. | Fe2O3与Al的反应属于吸热反应 | |
| B. | Fe2O3与NaN3反应,每消耗1molFe2O3产生9molN2 | |
| C. | Fe2O3与CO的反应属于置换反应 | |
| D. | 常温下K2FeO4在水中的溶解度比Na2FeO4的大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com