
【题目】已知醋酸、醋酸根离子在溶液中存在下列平衡及其对应的平衡常数
CH3COOH![]() CH3COO-+H+ K1=1.75×10-5 △H1>0
CH3COO-+H+ K1=1.75×10-5 △H1>0
CH3COO-+H2O![]() CH3COOH+OH- K2=5.71×10-10 △H2>0
CH3COOH+OH- K2=5.71×10-10 △H2>0
常温下,将等体积、等物质的量浓度的醋酸和醋酸钠溶液混合,则下列叙述正确的是( )
A.对混合溶液进行微热,K1增大、K2减小
B.混合溶液的pH>7
C.温度不变,若在混合溶液中加入少量NaOH固体,则c(CH3COO-)减小
D.混合溶液中c(CH3COO-)>c(Na+)
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】以黄铁矿为原料制硫酸产生的硫酸渣中含Fe2O3、SiO2、Al2O3、MgO等,用硫酸渣制备铁红(Fe2O3)的过程如下:

(1)酸溶过程中Fe2O3与稀硫酸反应的化学方程式为 ;“滤渣A”主要成份的化学式为 。
(2)还原过程中加入FeS2的目的是将溶液中的Fe3 +还原为Fe2 +,而本身被氧化为H2SO4,请完成该反应的离子方程式:FeS2 + 14Fe3 + + H2O=15Fe2 + + SO42- + 。
(3)氧化过程中,O2、NaOH与Fe2+反应的离子方程式为 ;
(4)为了确保铁红的质量,氧化过程需要调节溶液的pH的范围是 (几种离子沉淀的pH见下表);滤液B可以回收的物质有(写化学式)________________。
沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 |
开始沉淀pH | 2.7 | 3.8 | 7.6 | 9.4 |
完全沉淀pH | 3.2 | 5.2 | 9.7 | 12.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关摩尔的使用正确的是( )
A.1mol O的质量为16g·mol-1
B.0.5mol He约含有6.02×1023个电子
C.2H既表示2个氢原子又表示2mol氢原子
D.每摩尔物质均含有6.02×1023个原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:(1)NH4++OH-=NH3↑+H2O;2NO+O2=2NO2;3NO2+H2O=2HNO3+NO(2)微溶物在溶液中不能大量存在,会沉淀而析出某强酸性的X 溶液中可能含有 Fe2+、 A13+、 NH4+、 CO32―、 SO32―、 SO42―、 C1―中的若干种,现取 X溶液进行连续实验,实验过程及产物如下:
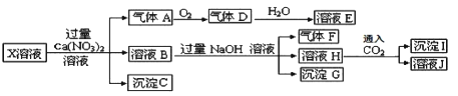
下列说法正确的是( )
A.气体A是NO2
B.X中肯定存在Fe2+、A13+、NH4+、SO42―
C.溶液E和气体F不能发生化学反应
D.X中不能确定的离子是A13+和C1―
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaClO和KAl(SO4)2都是重要的化工产品,均可应用于造纸业。
(1)NaClO溶液pH>7,用离子方程式表示原因_____________________。
(2)根据NaClO的性质推测,在纸浆中加入NaClO溶液的作用是_________________。
(3)某小组同学探究饱和NaClO和KAl(SO4)2溶液混合反应的实验。向饱和NaClO溶液中加入饱和KAl(SO4)2溶液,产生大量的白色胶状沉淀。反应的离子方程式是_______________________。
(4)常温下,pH=11的NaClO溶液中,水电离出来的c(OH-)=________,在pH=3的HClO溶液中,水电离出来的c(H+)=____________________________。
(5)已知纯水中存在如下平衡:H2O+H2O![]() H3O++OH- ΔH>0,现欲使平衡向右移动,且所得溶液显酸性,可选择的方法是________(填字母)。
H3O++OH- ΔH>0,现欲使平衡向右移动,且所得溶液显酸性,可选择的方法是________(填字母)。
A.向水中加入NaHSO4固体
B.向水中加Na2CO3固体
C.加热至100 ℃[其中c(H+)=1×10-6 mol·L-1]
D.向水中加入(NH4)2SO4固体
(6)若将等pH、等体积的②NaOH溶液和⑦NH3·H2O溶液分别加水稀释m倍、n倍,稀释后两种溶液的pH仍相等,则m________n(填“<”、“>”或“=”)。
(7) 在25 ℃时,将0.2 mol NaA晶体和0.1 mol HA气体同时溶解于同一烧杯的水中,制得1 L溶液,则c(HA)+c(A-)= mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中不正确的是
A. 生铁中含有碳,抗腐蚀能力比纯铁弱 B. 铁管上镶嵌锌块可形成合金
C. 镁铝合金耐腐蚀,但能被烧碱溶液腐蚀 D. 合金在潮湿环境中更容易被腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)氨的水溶液显弱碱性,其原因为 (用离子方程式表示),0.1 mol·L-1的氨水中加入少量的NH4Cl固体,溶液的PH (填“升高”或“降低”);若加入少量的明矾,溶液中的NH4+的浓度 (填“增大”或“减小”)。
(2)硝酸铵加热分解可得到N2O和H2O,250℃时,硝酸铵在密闭容器中分解达到平衡,该分解反应的化学方程式为 ,平衡常数表达式为 ;若有1mol硝酸铵完全分解,转移的电子数为 mol。
(3)由N2O和NO反应生成N2和NO2的能量变化如图所示,若生成1molN2,△H= kJ·mol-1。
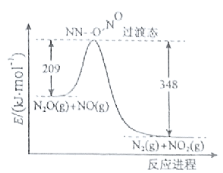
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列属于氧化还原反应的是
A. 2KBr + Cl2=2KCl + Br2 B. CaCO3=CaO +CO2↑
C. SO3 + H2O=H2SO4 D. MgCl2 + 2NaOH=Mg(OH)2↓ + NaCl
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com