

 .
.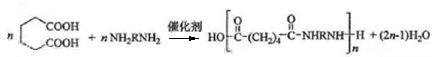 .
. $\stackrel{溴的四氯化碳溶液}{→}$
$\stackrel{溴的四氯化碳溶液}{→}$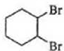 $→_{△}^{氢氧化钠/醇}$
$→_{△}^{氢氧化钠/醇}$ .
.分析 化合物A中含碳87.8%,其余为氢,则碳氢原子个数比为:$\frac{0.878}{12}$:$\frac{1-0.878}{1}$=6:10,又知A含有六个碳原子,故A的化学名称为:C6H10,与双氧水反应生成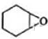 ,
, 与水发生加成反应生成
与水发生加成反应生成 ,
, 发生氧化反应生成
发生氧化反应生成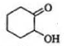 ,
, 再发生氧化反应生成
再发生氧化反应生成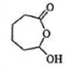 ,
, 再发生氧化反应生成F,F为:
再发生氧化反应生成F,F为: ,
, 再发生氧化反应生成
再发生氧化反应生成 ,
, 与
与 发生缩聚反应生成尼龙,化学式为:
发生缩聚反应生成尼龙,化学式为: .
.
解答 解:化合物A中含碳87.8%,其余为氢,则碳氢原子个数比为:$\frac{0.878}{12}$:$\frac{1-0.878}{1}$=6:10,又知A含有六个碳原子,故A的化学名称为:C6H10,与双氧水反应生成 ,
, 与水发生加成反应生成
与水发生加成反应生成 ,
, 发生氧化反应生成
发生氧化反应生成 ,
, 再发生氧化反应生成
再发生氧化反应生成 ,
, 再发生氧化反应生成F,F为:
再发生氧化反应生成F,F为: ,
, 再发生氧化反应生成
再发生氧化反应生成 ,
, 与
与 发生缩聚反应生成尼龙,化学式为:
发生缩聚反应生成尼龙,化学式为: ,
,
(1)根据上面的分析可知,A的化学式为:C6H10,故A的化学名称为:环己烯;
故答案为:环己烯;
(2) 与水发生加成反应生成
与水发生加成反应生成 ,
,
故答案为:加成反应;
(3) 发生氧化反应生成F,F为
发生氧化反应生成F,F为 ,故答案为:
,故答案为: ;
;
(4)B的核磁共振氢谱出峰为3,C的核磁共振氢谱出峰为4,D的核磁共振氢谱出峰为6,E的核磁共振氢谱出峰为6,F的核磁共振氢谱出峰为2,
故答案为:DE;F;
(5) 与
与 发生缩聚反应生成
发生缩聚反应生成 ,方程式为:
,方程式为: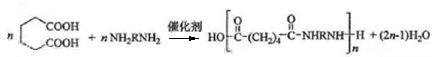 ,
,
故答案为: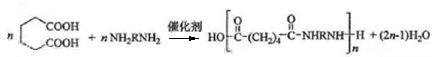 ;
;
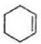
(6)由环已烯合成1,3-环己二烯,可以用环已烯与溴发生加成反应生成1,2-二溴环已烷,1,2-二溴环已烷再在氢氧化钠醇溶液中发生消去反应得 ,合成路线为
,合成路线为 $\stackrel{溴的四氯化碳溶液}{→}$
$\stackrel{溴的四氯化碳溶液}{→}$ $→_{△}^{氢氧化钠/醇}$
$→_{△}^{氢氧化钠/醇}$ ,
,
故答案为: $\stackrel{溴的四氯化碳溶液}{→}$
$\stackrel{溴的四氯化碳溶液}{→}$ $→_{△}^{氢氧化钠/醇}$
$→_{△}^{氢氧化钠/醇}$ ;
;
(7)根据有机物C的结构简式可知,C有一个不饱和度,所以C的同分异构体属于酯类的物质应为链状酯,可以为甲酸戊酯,有7种,也可以是乙酸丁酯,有4种,或者是丙酸丙酯,有2种,或者是丁酸乙酯,有2种,或者是戊酸甲酯,有4种,所以共有19种,
故答案为:20.
点评 本题考查有机物的合成,为高频考点,题目难度中等,试题侧重于学生的分析能力的考查,熟练掌握常见有机物结构与性质为解答关键,注意对题目反应信息的理解利用,结合题给合成信息以及物质的性质解答该题.


 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:解答题
 ,CH(CH3)3的名称为:2-甲基丙烷.
,CH(CH3)3的名称为:2-甲基丙烷.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 它的式量为720 | |
| B. | 它是一种单质 | |
| C. | 它是一种新型的共价化合物 | |
| D. | 它在氧气中燃烧的产物和碳在氧气中燃烧的产物相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10mL 0.1mol/L的FeCl3溶液 | B. | 20mL 0.1mol/L的MgCl2溶液 | ||
| C. | 30mL 0.2mol/L的KCl溶液 | D. | 100mL 0.25mol/L的HCl溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 形成1 mol H-Cl键放出的能量 | |
| B. | 石墨转变成金刚石吸收的能量 | |
| C. | 1 mol O2形成2 mol O原子吸收的能量 | |
| D. | 水蒸气变成液态水放出的能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 其水溶液显强酸性,俗称石炭酸 | |
| B. | 其浓溶液对皮肤有强烈的腐蚀性,如果不慎沾在皮肤上,应立即用NaOH擦洗 | |
| C. | 其在水中的溶解度随温度的升高而增大,超过65℃可以与水以任意比互溶 | |
| D. | 碳酸氢钠溶液中滴入苯酚的水溶液后立即放出二氧化碳 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com