
【题目】下列关于氨气性质的说法中,错误的是
A.有刺激性气味B.不跟水反应C.能跟盐酸反应D.比空气密度小
科目:高中化学 来源: 题型:
【题目】铜基及硼系高温超导材料都具有良好的应用前景。回答下列问题:
(1)写出Cu原子价电子的轨道表达式:____________。BF3的立体构型是____________。
(2)NaBH4被认为是有机化学上的“万能还原剂”, NaBH4电子式为____________,其中三种元素的第一电离能由大到小的顺序是_________________。
(3)BH3·NH3是一种有效、安全的固体储氢材料,结构如右图所示。 B原子的轨道杂化类型是____________。该物质中含有配位键,其中提供空轨道接受孤对电子的是____________。该物质易溶于水,其原因是____________。
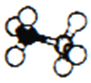
(4)硼与氦形成类似苯的化合物B3N3H6(硼氮苯),俗称无机苯。硼氮苯属于分子____________(填“极性”或“非极性”),一个硼氮苯分子中有____________个σ键,形成π键的电子由____________提供。
(5)硼与镁形成的高温超导材料晶体结构如图所示。该六方晶胞中镁原子与硼原子的数量比为____________,晶体密度d=____________g·cm-3。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于丙烯(CH3—CH = CH2)的说法不正确的
A. 丙烯分子有8个σ键,1个π键 B. 丙烯分子中碳原子有两种杂化方式
C. 丙烯分子至少有六个原子在同一平面上 D. 丙烯分子中3个碳原子在同一直线上
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】自然界中的许多植物中含有醛,其中有些具有特殊香味,可作为植物香料使用,例如桂皮含肉桂醛(![]() ),杏仁含苯甲醛(
),杏仁含苯甲醛(![]() ),下列说法错误的是( )
),下列说法错误的是( )
A. 肉桂醛和苯甲醛互为同系物
B. 肉桂醛能发生加成反应、取代反应和加聚反应
C. 可用新制氢氧化铜悬浊液检验肉桂醛分子中的含氧官能团
D. 苯甲醛分子中所有原子可能位于同一平面内
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含氮化合物在生活、生产和科技等方面有重要的应用。
⑴已知298 K时,亚硝酸(HNO2)的电离平衡常数Ka=5.1×10-4,H2CO3的电离平衡常数 Ka1=4.2×10-7、Ka2=5.61×10-11。
① NaNO2溶液呈____(填“酸性”“碱性”或“中性”),原因是_________(用离子方程式表示)。
②向含有1 mol碳酸钠的溶液中加入1 mol HNO2后,溶液中c(CO32-)、c(HCO3-)、c(NO2-)由大到小的顺序为________________。
(2)电化学催化净化NO是处理含氮化合物的一种新方法,原理如图所示,固体电解质起到传导O2-的作用。b极为电源的_____(填“正极”或“负极”),通入NO的电极上的电极反应式为______。

⑶N2O5是绿色硝化剂,能溶于水生成硝酸。常温下,向0.1 mol·L-1的氨水中加入少量N2O5,使溶液中c(NH3H2O):c(NH4+)=5 : 9,此时溶液中 c(NH4+)+c(H+) — c(NO3-)=_____。 (25℃时,NH3H2O的电离常数Kb=1.8×10-5)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na2S2O3是重要的化工原料,易溶于水,在中性或碱性环境中稳定,在酸性环境下易分解生成S和SO2。某小组设计了如下实验装置制备Na2S2O3(夹持及加热仪器略),总反应为2Na2S+Na2CO3+4SO2 ![]() 3Na2S2O3+CO2。回答下列问题:
3Na2S2O3+CO2。回答下列问题:

(1)装置A的作用是制备______________,反应的化学方程式为______________。
(2)完成下表实验过程:
操作步骤 | 装置C的实验现象 | 解释原因 |
检查装置气密性后,添加药品 | pH计读数约为13 | 用离子方程式表示(以S2-为例): ① |
打开K2,关闭K3,调节K1使硫酸缓慢匀速滴下 | ⅰ.导管口有气泡冒出, ② ⅱ.pH计读数逐渐 ③ | 反应分步进行: Na2CO3+SO2 2Na2S+3SO2 Na2SO3+S |
当pH计读数接近7时,立即停止通SO2,操作是 ④ | 必须立即停止通SO2的原因是: ⑤ |
(3)Na2S2O3有还原性,可作脱氯剂。向Na2S2O3溶液中通入少量Cl2,某同学预测S2O32-转变为SO42-,设计实验验证该预测:取少量反应后的溶液于试管中,______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某地煤矸石经预处理后含SiO2(63%)、Al2O3(25%)、Fe2O3(5%)等,一种综合利用工艺设计如下:

(1)“酸浸”时,提高浸出速率的具体措施有_____________,________________(写出两个)
(2)“酸浸”过程中主要反应的离子方程式为:________________,________________
(3)“碱溶”的目的是___________________物质X的化学式为__________________
(4)从流程中分离出来的Fe(OH)3沉淀可在碱性条件下用KClO溶液处理,制备新型水处理剂高铁酸钾(K2FeO4),该反应的离子方程式为:_________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com