
 计算盐酸的物质的量浓度;
计算盐酸的物质的量浓度;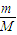 计算二氧化锰的物质的量,再根据方程式计算生成的氯气的物质的量,被氧化HCl生成氯气,故被氧化铝的HCl的物质的量是氯气的2倍;
计算二氧化锰的物质的量,再根据方程式计算生成的氯气的物质的量,被氧化HCl生成氯气,故被氧化铝的HCl的物质的量是氯气的2倍;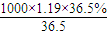 mol/L=11.9mol/L,
mol/L=11.9mol/L, =0.05mol,则:
=0.05mol,则: =0.025mol,
=0.025mol,

科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:化学(高一上)单元同步1+1测试卷 题型:038
用足量的浓硫酸与15.35g氯化钠与氯化镁的混合物加强热反应,把生成的氯化氢溶于适量的水中,加入二氧化锰氧化(假设盐酸能完全反应),将生成的氯气通入碘化钾溶液中,得到19.05g碘,求混合物中氯化钠的质量分数.
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com