
| A | B | ||||||
| D | E | F | |||||
| C | I | G | H |
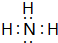 ;该物质溶于水后的溶液呈碱性(填“酸”、“碱”或“中”).用电子式表示I与H形成的化合物的形成过程:
;该物质溶于水后的溶液呈碱性(填“酸”、“碱”或“中”).用电子式表示I与H形成的化合物的形成过程: .
.分析 由短周期元素的位置,可知A为H、B为He、C为Na、D为C、E为N、F为O、G为Si、H为Cl、I为Mg.
(1)Si单质、碳的单质都可以形成原子晶体,但C-C键键长比Si-Si键键长短,C-C键更强;
(2)非金属性越强,对应氢化物越稳定;
(3)A与E可形成一种极易溶于水的气态化合物为NH3,其水溶液呈碱性;I与H形成的化合物为MgCl2,由镁离子与氯离子构成;
(4)A、F、C构成的化合物为NaOH,含有离子键、共价键,溶于水电离出钠离子与氢氧根离子.
解答 解:由短周期元素的位置,可知A为H、B为He、C为Na、D为C、E为N、F为O、G为Si、H为Cl、I为Mg.
(1)Si单质、碳的单质都可以形成原子晶体,但C-C键键长比Si-Si键键长短,C-C键更强,故碳单质的熔点可能最高,故答案为:碳;
(2)C、Si同主族,自上而下非金属性增强,氢化物的稳定性增强,故氢化物稳定性CH4>SiH4,故答案为:碳的非金属性比硅的强;
(3)A与E可形成一种极易溶于水的气态化合物为NH3,分子中N原子与H原子之间形成1对共用电子对,电子式为: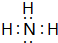 ,溶于水后溶液中一水合氨电离:NH3.H2O?NH4++OH-,溶于呈碱性;I与H形成的化合物为MgCl2,由镁离子与氯离子构成,用电子式表示形成过程为:
,溶于水后溶液中一水合氨电离:NH3.H2O?NH4++OH-,溶于呈碱性;I与H形成的化合物为MgCl2,由镁离子与氯离子构成,用电子式表示形成过程为: ,
,
故答案为: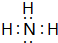 ;碱;
;碱; ;
;
(4)A、F、C构成的化合物为NaOH,含有离子键、极性共价键,溶于水电离出钠离子与氢氧根离子,离子键被破坏,故答案为:离子;极性共价;离子.
点评 本题考查元素周期表与元素周期律的综合应用,难度不大,注意用电子式表示化学键或物质的形成过程.


科目:高中化学 来源: 题型:多选题
| A. | 由CO或CO2单独组成的纯净物 | B. | 由CO和CO2共同组成的混合物 | ||
| C. | 由CO2和O2共同组成的混合物 | D. | 由CO、CO2和O2共同组成的混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含有NA个氦原子的氦气在标准状况下的体积约为11.2L | |
| B. | 25℃,1.01×105 Pa,32gO2所含原子数为NA | |
| C. | 标准状况下,11.2LH2O含有的分子数为0.5NA | |
| D. | 在常温常压下,44gCO2含有的分子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题




 +2Cu(OH)2+NaOH$\stackrel{△}{→}$
+2Cu(OH)2+NaOH$\stackrel{△}{→}$ +Cu2O↓+3H2O.
+Cu2O↓+3H2O. .
.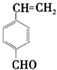 和
和 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碱性条件下,NaNO2的氧化性比Na2FeO2、Na2Fe2O4都强 | |
| B. | 反应 ①、②、③均是氧化还原反应 | |
| C. | 反应 ②配平后,H2O的化学计量数是5 | |
| D. | 整个反应过程中每有16.8g Fe参加反应转移0.8mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com