
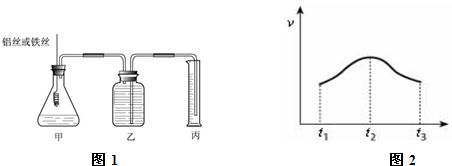
(12分)某研究小组为比较Al和Fe的金属性强弱,设计了图1所示的装置。
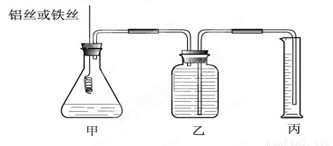
(1)甲中锥形瓶内盛放的液体是_______________________。
(2)若要比较产生气体的快慢,可以比较相同时间内产生气体的体积,也可以比较_ 。
(3)为了确保“Al和Fe的金属活动性不同是导致产生气体速率不同的唯一原因”,实验时需要控制好反应条件。实验时除需保证甲中液体的体积、物质的量浓度和温度相同外,还需保证___________。
(4)某兴趣小组同学利用氧化还原反应:2KMnO4+10FeSO4+8H2SO4===2MnSO4+5Fe2(SO4)3+K2SO4+8H2O设计如下原电池,其中甲、乙两烧杯中各物质的物质的量浓度均为1 mol·L-1,盐桥中装有饱和K2SO4溶液.回答下列问题:

(注:盐桥常出现在原电池中,是由琼脂和和K2SO4溶液构成的,用来在两种溶液中转移电子。)
(i)发生氧化反应的烧杯是_______ (填“甲”或“乙”).
(ii)外电路的电流方向为:从______到____.(填“a”或“b”)
(iii)电池工作时,盐桥中的SO移向______(填“甲”或“乙”)烧杯.
(iv)甲烧杯中发生的电极反应式为_________.
(12分)(1)稀盐酸(或稀硫酸)(2分) (2)产生相同体积气体所需的时间(2分)
(3)金属与酸的接触面积相同(只要意思说到就给分)(2分)
(4)(i)乙(1分) (ii)a b (2分) (iii)乙(1分)
(iv)MnO4-+8H++5e-=Mn2++4H2O(2分)
【解析】
试题分析:(1)应用铝或铁和氧化性酸反应得不到氢气,所以该实验中需要的酸应该是稀盐酸或稀硫酸。
(2)若要比较产生气体的快慢,可以比较相同时间内产生气体的体积。反之也可以比较产生相同体积气体所需的时间。
(3)要通过比较生成的氢气的快慢,则必须保证其它条件都是相同的,即实验时除需保证甲中液体的体积、物质的量浓度和温度相同外,还需保证金属与酸的接触面积相同。
(4)(i)根据总的反应式可知,硫酸亚铁失去电子,发生氧化反应,所以发生氧化反应的烧杯应该是乙。
(ii)原电池中负极失去电子,正极得到电子,所以根据装置可知a是正极,b是负极。则外电路的电流方向为:从a到b。
(iii)乙烧杯中亚铁离子被氧化生成铁离子,正电荷增加,所以阴离子向负极方向移动,即向乙烧杯中移动。
(iv)甲烧杯是正极,得到电子,所以发生的电极反应式为MnO4-+8H++5e-=Mn2++4H2O。
考点:考查影响反应速率的条件、原电池中有关判断以及电极反应式的书写
点评:在判断影响反应速率的因素时,必须是在其它条件不变的情况下进行分析。另外在原电池中较活泼的金属作负极,失去电子,发生氧化反应。电子经导线传递到正极上,所以溶液中的阳离子向正极移动,阴离子向负极移动。正极得到电子,发生还原反应,据此可以进行有关的判断和计算。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:2011-2012学年江西上饶中学高一零点、实验班下期末化学试卷(带解析) 题型:实验题
(12分)某研究小组为比较Al和Fe的金属性强弱,设计了图1所示的装置。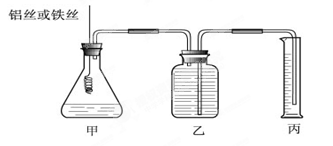
(1)甲中锥形瓶内盛放的液体是_______________________。
(2)若要比较产生气体的快慢,可以比较相同时间内产生气体的体积,也可以比较_ 。
(3)为了确保“Al和Fe的金属活动性不同是导致产生气体速率不同的唯一原因”,实验时需要控制好反应条件。实验时除需保证甲中液体的体积、物质的量浓度和温度相同外,还需保证___________。
(4)某兴趣小组同学利用氧化还原反应:2KMnO4+10FeSO4+8H2SO4===2MnSO4+5Fe2(SO4)3+K2SO4+8H2O设计如下原电池,其中甲、乙两烧杯中各物质的物质的量浓度均为1 mol·L-1,盐桥中装有饱和K2SO4溶液.回答下列问题: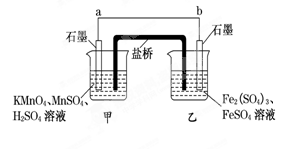
(注:盐桥常出现在原电池中,是由琼脂和和K2SO4溶液构成的,用来在两种溶液中转移电子。)
(i)发生氧化反应的烧杯是_______ (填“甲”或“乙”).
(ii)外电路的电流方向为:从______到____.(填“a”或“b”)
(iii)电池工作时,盐桥中的SO移向______(填“甲”或“乙”)烧杯.
(iv)甲烧杯中发生的电极反应式为_________.
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com