
| A. | 所用氢氧化钠已经潮解 | |
| B. | 向容量瓶中加水未到刻度线 | |
| C. | 有少量的氢氧化钠残留在烧杯中 | |
| D. | 用带游码的托盘天平称2.4g氢氧化钠时误用了“左码右物”的操作 |
分析 分析操作对溶质的物质的量n和溶液体积V的影响,依据c=$\frac{n}{V}$分析,凡是使n偏小或者使V偏大的操作都会使溶液浓度偏低,凡是使n偏达或者使V偏小的操作都会使溶液浓度偏高,据此解答.
解答 解:A.所用氢氧化钠已经潮解,氢氧化钠吸收空气中水、二氧化碳,导致称取的固体中含有氢氧化钠的物质的量偏小,溶液浓度偏低,故A不选;
B.向容量瓶中加水未到刻度线,导致溶液体积偏小,溶液浓度偏高,故B选;
C.有少量的氢氧化钠残留在烧杯中,导致溶质的物质的量偏小,溶液浓度偏低,故C不选;
D.用带游码的托盘天平称2.4gNaOH时误用了“左码右物”方法,将造成溶质的物质的量偏小,故所配溶液的浓度偏低;故D不选;
故选:B.
点评 本题以溶液配制为载体,考查了错误或不规范操作引起误差分析,准确分析错误操作对溶质的物质的量和溶液体积影响依据c=$\frac{n}{V}$即可解答,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:多选题
| A. | 4:3:2 | B. | 1:2:1 | C. | 2:1:1 | D. | 1:1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可能含甲烷 | B. | 可能是甲烷和丙炔的混合气体 | ||
| C. | 一定是甲烷和乙烯的混合气体 | D. | 一定含乙烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 在pH=9.0时,c(NH4+)>c(HCO3-)>c(NH2COOˉ)>c(CO32-) | |
| B. | 随着CO2的通入,$\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$不断增大 | |
| C. | 在溶液中pH不断降低的过程中,有含NH2COOˉ的中间产物生成 | |
| D. | 不同pH的溶液中有:c(NH4+)+c(H+)=2c(CO32-)+c(HCO3-)+c(NH2COOˉ)+c(OHˉ) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
. HN3+OH-.
HN3+OH-.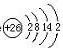 ,
,查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2为还原产物 | |
| B. | 当x=2时,每生成1 mol N2,转移电子数为4 mol | |
| C. | 等物质的量N2和CO2中,共价键的个数比为3:4 | |
| D. | 氧化剂与还原剂的物质的量之比为1:1时,NOx中氮元素的化合价为+2价 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,醋酸钠与醋酸的混合溶液pH=7,c(Na+)=c(CH3COO-) | |
| B. | 常温下,将pH=1的醋酸溶液稀释100倍后,水电离的c(H+)=10-11mol/L | |
| C. | 0.1 mol/L Na2CO3溶液中:c(OH-)=c(HCO3-)+c(H+)+2c(H2CO3) | |
| D. | 0.1mol/L NaHCO3溶液中:c(Na+)+c(H+)=c(HCO3-)+c(OH-)+2c(CO32-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com