
下列离子方程式书写正确的是
A.向NaAlO2溶液中通入过量CO2制A1(OH)3:2AlO2-+CO2+3H2O===2Al(OH)3↓+CO32-
B.向Fe(NO3)3溶液中加入过量的HI溶液:2NO3-+8H++6I-===3I2+2NO↑+4H2O
C.用硫酸酸化的淀粉碘化钾溶液在空气中变蓝:4I-+O2+4H+===2I2+2H2O
D.向NH4Al(SO4)2溶液中滴加Ba(OH)2恰好使SO42-反应完全:2Ba2++4OH-+A13++2SO42-===2BaSO4↓+A1O2-+2H2O
科目:高中化学 来源:2015-2016学年江西吉安一中高二下第二次段考化学试卷(解析版) 题型:选择题
下列实验操作过程能引起结果偏高的是
①用已知浓度的盐酸滴定未知浓度的NaOH溶液时,酸式滴定管未用标准液润洗.
②用量筒量取5.0mL溶液时,俯视读数.
③配制一定物质的量浓度的硫酸溶液,定容时仰视容量瓶的刻度线.
④用已知浓度的盐酸滴定未知浓度的NaOH溶液时,滴定前平视读数,滴定终点仰视读数.
A.③④ B.②③ C.①④ D.①②
查看答案和解析>>
科目:高中化学 来源:2016届辽宁省高三下第四次模拟理综化学试卷(解析版) 题型:简答题
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。
(1)在固定体积的密闭容器中,进行如下化学反应: N2(g)+3H2(g)  2NH3(g)
2NH3(g)  H=-92.4 kJ/mol,其平衡常数K与温度T的关系如下表:
H=-92.4 kJ/mol,其平衡常数K与温度T的关系如下表:
T/K | 298 | 398 | 498 |
平衡常数K | 4.1×106 | K1 | K2 |
①试判断K1 K2(填写“>”“=”或“<”)。
②如果合成氨反应的方程式写为 N2(g)+
N2(g)+  H2(g)
H2(g) NH3(g),其平衡常数为K’,则K’与K的关系为_________(填字母)
NH3(g),其平衡常数为K’,则K’与K的关系为_________(填字母)
A.K’ = K B.K’ = 2K C. K’ =  K D.K’ =
K D.K’ = 
(2)下列各项能说明合成氨反应已达到平衡状态的是 (填字母)(反应是在固定体积的密闭容器中进行的)
a.容器内N2、H2、NH3的浓度之比为1∶3∶2 b.v(N2)(正) = 3v(H2)(逆)
c.容器内压强保持不变 d.混合气体的密度保持不变
e.混合气体的平均摩尔质量不变
(3)将0.3 mol N2和0.5 mol H2充入体积不变的密闭容器中,在一定条件下达到平衡,测得容器内气体压强变为原来的 ,此时H2的转化率为 ;欲提高该容器中H2的转化率,下列措施可行的是 (填选项字母)。
,此时H2的转化率为 ;欲提高该容器中H2的转化率,下列措施可行的是 (填选项字母)。
A.向容器中按原比例再充入原料气 B.向容器中再充入一定量H2
C.改变反应的催化剂 D.液化生成物分离出氨
(4)盐酸肼(N2H6Cl2)是一种重要的化工原料,属于离子化合物,易溶于水,溶液呈酸性,水解原理与NH4Cl类似。
①写出盐酸肼第一步水解反应的离子方程式 ;
②盐酸肼水溶液中离子浓度的排列顺序正确的是 (填序号)。
A.c(Cl-)>c(N2H62+)>c(H+)>c(OH-)
B.c(Cl-)>c([N2H5·H2O+])> c(H+)>c(OH-)
C.2 c(N2H62+)+ c([N2H5·H2O] +)= c(H+)+c(OH-)
D.c(N2H62+)> c(Cl-)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源:2016届湖北省黄冈市高三4月考试理综化学试卷(解析版) 题型:选择题
如图为元素周期表中前四周期的一部分,下列判断正确的是( )

A.原子半径:Z>M>R、M<X<Y
B.M与Z的原子核外电子数相差16
C.Q的最高价氧化物一定能溶于强酸
D.气态氢化物的还原性:X>Y、M>R
查看答案和解析>>
科目:高中化学 来源:2016届河北省高三模拟押题理综化学试卷(解析版) 题型:简答题
甲醇是一种优质燃料,在工业上常用CO和H2合成甲醇,反应方程式为CO(g)+2H2(g)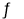 CH3OH(g)。
CH3OH(g)。
已知:
①CO(g)+1/2O2(g)=CO2(g) △H1=-283.0kJ/mol
②H2(g)+1/2O2(g)=H2O(g) △H2=-241.8kJ/mol
③CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(g) △H3=-192.2kJ/mol
回答下列问题:
(1)计算CO(g)+2H2(g)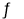 CH3OH(g)的反应热△H4=____________。
CH3OH(g)的反应热△H4=____________。
(2)若在绝热、恒容的密闭容器中充入1 mol CO、2 mol H2,发生CO(g)+2H2(g)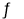 CH3OH(g)反应,下列示意图正确且能说明反应在进行到t1时刻为平衡状态的是________(填选项字母)。
CH3OH(g)反应,下列示意图正确且能说明反应在进行到t1时刻为平衡状态的是________(填选项字母)。
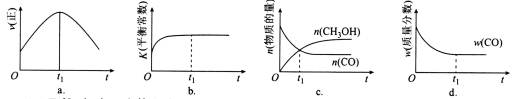
(3)T1℃时,在一个体积为5 L的恒容容器中充入1 mol CO、2 mol H2,经过5 min达到平衡,CO的转化率为0.8,则5 min内用H2表示的反应速率为v(H2)=_______。T1℃时,在另一体积不变的密闭容器中也充入1 mol CO、2 mol H2,达到平衡时CO的转化率为0.7,则该容器的体积____5 L(填“>”“<”或“=”);T1℃时,CO(g)+2H2(g)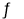 CH3OH(g)的平衡常数K=______________。
CH3OH(g)的平衡常数K=______________。
(4)在T1℃时,在体积为5 L的恒容容器中充入一定量的H2和CO,反应达到平衡时CH3OH的体积分数与n(H2)/n(CO)的关系如图所示。温度不变,当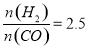 时,达到平衡状态,CH3OH的体积分数可能是图象中的______点。
时,达到平衡状态,CH3OH的体积分数可能是图象中的______点。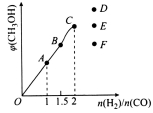
(5)为了提高燃料的利用率可以将甲醇设计为燃料电池,写出KOH作电解质溶液时,甲醇燃料电池的负极反应式:___________________。该电池负极与水库的铁闸相连时,可以保护铁闸不被腐蚀,这种电化学保护方法叫做___________。
(6)含有甲醇的废水随意排放会造成水污染,可用ClO2将其氧化为CO2,然后再加碱中和即可。写出处理甲醇酸性废水过程中,ClO2与甲醇反应的离子方程式:___________________。
查看答案和解析>>
科目:高中化学 来源:2016届福建师大附中高三下学期模拟考试理综化学试卷(解析版) 题型:推断题
【化学——选修5:有机化学基础】(15分)醋硝香豆素是一种治疗心脑血管疾病的药物,能阻碍血栓扩展,其结构简式为: 。醋硝香豆素可以通过以下方法合成(部分反应条件省略)。
。醋硝香豆素可以通过以下方法合成(部分反应条件省略)。

已知: + H2O
+ H2O
回答以下问题:
(1)反应①的反应类型是 ;从A到B引入的官能团名称是 。
(2)反应②的条件是 。
(3)反应③的化学方程式为 。
(4)关于E物质,下列说法正确的是 (填字母序号)。
a.在核磁共振氢谱中有四组吸收峰
b.可以用酸性高锰酸钾溶液鉴别D和E
c.可以发生加成反应、聚合反应、氧化反应和还原反应
d.存在顺反异构
(5)写出G的结构简式 。
(6)分子结构中只含有一个环,且同时符合下列条件的G的同分异构体共有 种。
①可与氯化铁溶液发生显色反应; ②可与碳酸氢钠溶液反应生成二氧化碳气体。
其中,苯环上的一氯代物只有两种的同分异构体的结构简式为 。
查看答案和解析>>
科目:高中化学 来源:2016届福建师大附中高三下学期模拟考试理综化学试卷(解析版) 题型:选择题
在固态金属氧化物电解池中,高温共电解H2O-CO2混合气体制备H2和CO是一种新的能源利用方式,基本原理如图所示。下列说法正确的是

A.X是电源的正极
B.阳极的反应式是: 4OH--4eˉ=2H2O+O2↑
C.总反应可表示为:H2O+CO2 = H2+CO+O2
D.阴、阳两极生成的气体的物质的量之比是1︰1
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省高一平行班下期中化学试卷(解析版) 题型:选择题
下列措施对增大反应速率明显有效的是( )
A.Na与水反应时增大水的用量
B.Fe与稀硫酸反应制取氢气时,改用浓硫酸
C.在K2SO4与BaCl2两溶液反应时,增大压强
D.将铝片改为铝粉,做铝与氧气反应的实验
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省高二下期中化学试卷(解析版) 题型:选择题
下列事实一定能证明HNO2是弱电解质的是( )
 ①常温下NaNO2溶液pH大于7 ②用HNO2溶液做导电实验,灯泡很暗
①常温下NaNO2溶液pH大于7 ②用HNO2溶液做导电实验,灯泡很暗
③HNO2和NaCl不能发生反应 ④0.1mol•L﹣1HNO2溶液的pH=2.1[
⑤NaNO2和H3PO4反应,生成HNO2 ⑥0.1mol•L﹣1HNO2溶液稀释至100倍,pH约为3.1
A.①④⑥ B.①②③④ C.①④⑤⑥ D.全部
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com