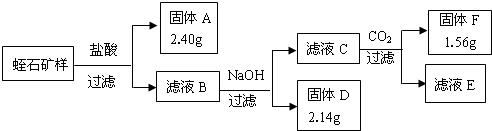
解:蛭石的成分可看成是由MgO、Fe
2O
3、Al
2O
3、SiO
2,每次转化所得固体成分只有一种,由工艺流程图可知固体A为SiO
2;滤液B含有氯化镁、氯化铁、氯化铝等,滤液B加入氢氧化钠溶液,由氢氧化铁、氢氧化镁、氢氧化铝开始沉淀及沉淀完全时的pH值可知,固体D为氢氧化铁,滤液C含有氯化镁、偏铝酸钠、氯化钠;滤液C通入二氧化碳,可知固体F为氢氧化铝,滤液E含有氯化镁、氯化钠等.
(1)D为氢氧化铁可以加热分解制备氧化铁红色颜料,反应方程式为2Fe(OH)
3
Fe
2O
3+3H
2O.
故答案为:2Fe(OH)
3
Fe
2O
3+3H
2O.
(2)滤液E含有氯化镁、氯化钠等,向将所得的滤液E中加入足量的NaOH溶液,再进行过滤、洗涤、干燥,得氢氧化镁沉淀,最后进行高温灼烧氢氧化镁可以生成氧化镁,制取耐火材料.
故答案为:向将所得的滤液E中加入足量的NaOH溶液,再进行过滤、洗涤、干燥,最后进行高温灼烧.
(3)根据表中数据,控制溶液的pH在7~8之间,Mg
2+没有变化,Al
3+转化为AlO
2-,只有Fe
3+沉淀,保证沉淀只有Fe(OH)
3.
故答案为:根据表中数据,控制溶液的pH在7~8之间,Mg
2+没有变化,Al
3+转化为AlO
2-,只有Fe
3+沉淀,保证沉淀只有Fe(OH)
3.
(4)固体A为SiO
2质量为2.4g,物质的量为

=0.04mol;
D为氢氧化铁,质量为2.14g,物质的量为

=0.02mol,根据铁元素守恒可知氧化铁物质的量为0.01mol,质量为0.01mol×160g/mol=1.6g;
F为氢氧化铝,质量为1.56g,物质的量为

=0.02mol,根据铝元素守恒可知氧化铝物质的量为0.01mol,质量为0.01mol×102g/mol=1.02g;
故氧化镁的质量为8.22g-2.4g-1.6g-1.02g=3.2g,物质的量为

=0.08mol,
所以n(MgO):n(Al
2O
3):n(Fe
2O
3):n(SiO
2 )=0.04mol:0.01mol:0.01mol:0.02mol=4:1:1:2.
所以用氧化物的形式表示蛭石组成的化学式为8MgO?Al
2O
3?Fe
2O
3?4SiO
2.
故答案为:8MgO?Al
2O
3?Fe
2O
3?4SiO
2.
分析:蛭石的成分可看成是由MgO、Fe
2O
3、Al
2O
3、SiO
2,每次转化所得固体成分只有一种,由工艺流程图可知固体A为SiO
2;滤液B含有氯化镁、氯化铁、氯化铝等,滤液B加入氢氧化钠溶液,由氢氧化铁、氢氧化镁、氢氧化铝开始沉淀及沉淀完全时的pH值可知,固体D为氢氧化铁,滤液C含有氯化镁、偏铝酸钠、氯化钠;滤液C通入二氧化碳,可知固体F为氢氧化铝,滤液E含有氯化镁、氯化钠等.
(1)D为氢氧化铁可以制备氧化铁红色颜料.
(2)滤液E含有氯化镁、氯化钠等,向滤液中加入足量的NaOH溶液,最后进行高温灼烧可得氧化镁.
(3)根据表中数据,控制溶液的pH在7~8之间,Mg
2+没有变化,Al
3+转化为AlO
2-,只有Fe
3+沉淀.
(4)固体A为SiO
2质量为2.4g,利用原子守恒,结合氢氧化铁、氢氧化铝沉淀质量计算8.22g中含有氧化铁、氧化铝的质量,再计算氧化镁的质量,进而计算MgO、Al
2O
3、Fe
2O
3、SiO
2 的物质的量之比.据此书写化学式.
点评:本题考查Mg、Al、Fe、Si等元素化合物知识与物质的分离提纯的应用、物质的量计算等知识点,难度中等,理解工艺流程图是解题关键,是对知识的综合运用与对学生能力考查.


 Fe2O3+3H2O.
Fe2O3+3H2O. Fe2O3+3H2O.
Fe2O3+3H2O. =0.04mol;
=0.04mol; =0.02mol,根据铁元素守恒可知氧化铁物质的量为0.01mol,质量为0.01mol×160g/mol=1.6g;
=0.02mol,根据铁元素守恒可知氧化铁物质的量为0.01mol,质量为0.01mol×160g/mol=1.6g; =0.02mol,根据铝元素守恒可知氧化铝物质的量为0.01mol,质量为0.01mol×102g/mol=1.02g;
=0.02mol,根据铝元素守恒可知氧化铝物质的量为0.01mol,质量为0.01mol×102g/mol=1.02g; =0.08mol,
=0.08mol,

 核心素养学练评系列答案
核心素养学练评系列答案 单元期中期末卷系列答案
单元期中期末卷系列答案