
(15分)一定条件下,在体积为3 L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):
CO(g)+2H2(g)
 CH3OH(g)
CH3OH(g)
根据题意完成下列各题:
(1)反应达到平衡时,平衡常数表达式K=
,升高温度,K值 (填“增大”、“减小”或“不变”)。
(2)在500℃,从反应开始到平衡,氢气的平均反应速率v(H2)=
(3)在其他条件不变的情况下,对处于E点的体系体积压缩到原来的1/2,下列有关该体系的说法正确的是
a. 氢气的浓度减少 b. 正反应速率加快,逆反应速率也加快
c. 甲醇的物质的量增加 d. 重新平衡时n(H2)/n(CH3OH)增大
(4)据研究,反应过程中起催化作用的为Cu2O,反应体系中含少量CO2有利于维持催化剂Cu2O的量不变,原因是: (用化学方程式表示)。
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| 化学反应 | 平衡常数 | 温度 | 973K | 1173K | ①Fe(s)+CO2(g)?FeO(s)+CO(g) | K1 | 1.47 | 2.15 | ②Fe(s)+H2O(g)?FeO(s)+H2(g) | K2 | 2.38 | 1.67 | ③CO(g)+H2O(g)?CO2(g)+H2(g) | K3 | ? | ? |
查看答案和解析>>
科目:高中化学 来源: 题型:
(15分)一定条件下,在体积为3 L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):
CO(g)+2H2(g) CH3OH(g)
根据题意完成下列各题:
(1)反应达到平衡时,平衡常数表达式K=
,升高温度,K值 (填“增大”、“减小”或“不变”)。
(2)在500℃,从反应开始到平衡,氢气的平均反应速率v(H2)=
(3)在其他条件不变的情况下,对处于E点的体系体积压缩到原来的1/2,下列有关该体系的说法正确的是
a. 氢气的浓度减少 b. 正反应速率加快,逆反应速率也加快
c. 甲醇的物质的量增加 d. 重新平衡时n(H2)/n(CH3OH)增大
(4)据研究,反应过程中起催化作用的为Cu2O,反应体系中含少量CO2有利于维持催化剂Cu2O的量不变,原因是: (用化学方程式表示)。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年浙江省温州四中高二下学期期中考试化学试卷(带解析) 题型:填空题
(12分)一定条件下,将SO2和O2充入一密闭容器中,发生如下反应:2SO2(g)+O2(g) 2SO3(g),△H<0。反应过程中SO2、O2、SO3物质的量变化如图所示:
2SO3(g),△H<0。反应过程中SO2、O2、SO3物质的量变化如图所示:
回答下列问题:
(1) 若降低温度,该反应的化学平衡常数 。(填“增大”“减小”或“不变”)
(2)该反应处于平衡状态的时间段为 。
(3)反应进行至20 min时,曲线发生变化的原因是 (用文字表达)。10 min到15 min的曲线变化的原因可能是 (填写编号)。
a. 加了催化剂 b. 缩小容器体积
c. 降低温度 d. 增加SO3的物质的量
(4)维持容器体积不变,向该反应的平衡体系中充入氮气 , 则平衡 ( 填“向左”或“向右”或“不”)移动;维持容器体积不变,向该反应的平衡体系中移走部分混合气体 , 则平衡 ( 填“向左”或“向右”或“不”) 移动。
查看答案和解析>>
科目:高中化学 来源:2013届浙江省高二下学期期中考试化学试卷(解析版) 题型:填空题
(12分)一定条件下,将SO2和O2充入一密闭容器中,发生如下反应:2SO2(g)+O2(g) 2SO3(g),△H<0。反应过程中SO2、O2、SO3物质的量变化如图所示:
2SO3(g),△H<0。反应过程中SO2、O2、SO3物质的量变化如图所示:
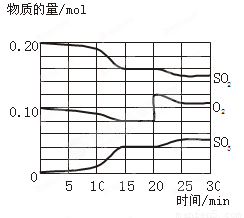
回答下列问题:
(1) 若降低温度,该反应的化学平衡常数 。(填“增大”“减小”或“不变”)
(2)该反应处于平衡状态的时间段为 。
(3)反应进行至20 min时,曲线发生变化的原因是 (用文字表达)。10 min到15 min的曲线变化的原因可能是 (填写编号)。
a. 加了催化剂 b. 缩小容器体积
c. 降低温度 d. 增加SO3的物质的量
(4)维持容器体积不变,向该反应的平衡体系中充入氮气 , 则平衡 ( 填“向左”或“向右”或“不”)移动;维持容器体积不变,向该反应的平衡体系中移走部分混合气体 , 则平衡 ( 填“向左”或“向右”或“不”) 移动。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com