
(1)已知0.5 mol CH4(g)与0.5 mol 水蒸气在t ℃、p kPa时,完全反应生成CO和H2的混合气体,吸收了a kJ热量,该反应的热化学方程式是
________________________________________________________________________。
(2)已知下列热化学方程式
Zn(s)+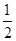 O2(g)===ZnO(s) ΔH1=-Q1 kJ/mol①
O2(g)===ZnO(s) ΔH1=-Q1 kJ/mol①
Hg(l)+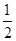 O2(g)===HgO(s) ΔH2=-Q2 kJ/mol②
O2(g)===HgO(s) ΔH2=-Q2 kJ/mol②
Zn(s)+HgO(s)===Hg(l)+ZnO(s) ΔH3=-Q3 kJ/mol③
则Q3与Q1和Q2的关系式为:Q3=________。
(1)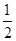 CH4(g)+
CH4(g)+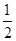 H2O(g)===
H2O(g)===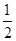 CO(g)+H2(g) ΔH(t ℃,p kPa)=+a kJ/mol
CO(g)+H2(g) ΔH(t ℃,p kPa)=+a kJ/mol
(2)Q1-Q2
解析试题分析:(1)0.5 mol CH4(g)与0.5 mol 水蒸气在t ℃、p kPa时,完全反应生成CO和H2的混合气体,吸收了a kJ热量,则该反应的热化学方程式是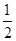 CH4(g)+
CH4(g)+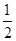 H2O(g)===
H2O(g)===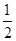 CO(g)+H2(g) ΔH(t ℃,p kPa)=+a kJ/mol。
CO(g)+H2(g) ΔH(t ℃,p kPa)=+a kJ/mol。
(2)根据盖斯定律可知,①-②即得到 Zn(s)+HgO(s)===Hg(l)+ZnO(s),所以该反应的反应热ΔH3=ΔH1-ΔH2,所以Q3=Q1-Q2。
考点:考查热化学方程式的判断,盖斯定律的应用
点评:该题是基础性试题的考查,试题难易适中,注重基础和能力的双向考查,有利于培养学生严谨的逻辑推理能力,提高学生分析问题、解决问题的能力。


科目:高中化学 来源:北京地区2007年4月模拟考试化学试题 题型:058
| |||||||||||||||||||||||
查看答案和解析>>
科目:高中化学 来源:长乐二中2007年高考化学实验预测题 题型:058
| |||||||||||||||||||||||
查看答案和解析>>
科目:高中化学 来源:2011-2012年辽宁省高二上学期第一次考试化学试卷 题型:填空题
(6分)在一个固定容积的密闭容器中,保持一定温度进行以下反应:H2(g)+Br2(g)  2HBr(g),已知加入0.5 mol H2和1 mol Br2时,达到平衡后生成0.5a mol HBr(见表已知项)在相同条件下,且保持平衡时各组分的体积分数不变,对下列编号(1)~(3)的状态,填写表中的空白。
2HBr(g),已知加入0.5 mol H2和1 mol Br2时,达到平衡后生成0.5a mol HBr(见表已知项)在相同条件下,且保持平衡时各组分的体积分数不变,对下列编号(1)~(3)的状态,填写表中的空白。
|
编号 |
起始状态/ mol |
平衡时HBr的物质的量 / mol |
||
|
H2 |
Br2 |
HBr |
||
|
已知 |
0.5 |
1 |
0 |
0.5a |
|
(1) |
2 |
4 |
0 |
① |
|
(2) |
② |
③ |
1 |
0.5a |
|
(3) |
m |
n(n≥2m) |
④ |
⑤ |
查看答案和解析>>
科目:高中化学 来源:模拟题 题型:填空题
 P(g)+Q(g) △H>0,请回答下列问题。
P(g)+Q(g) △H>0,请回答下列问题。 查看答案和解析>>
科目:高中化学 来源: 题型:
某校活动小组用下图所示装置及所给药品(图中夹持仪器已略去)探究工业制硫酸接触室中的反应,并测定此条件下二氧化硫的转化率。已知C中的浓硫酸含溶质m mol,假设气体进入C和D时分别被完全吸收,且忽略装置内空气中的CO2。
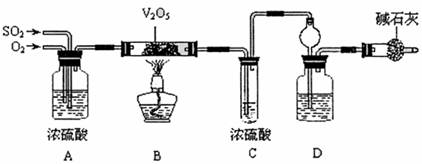
请回答下列问题:
(1)已知0.5 mol SO2被O2氧化成气态SO3,放出49.15kJ热量,反应的热化学方程式为 。
(2)检查完装置的气密性且加入药品后,开始进行实验,此时首先应进行的操作是
。
(3)实验时A中氧气导冒出的气泡与二氧化硫导管冒出的气泡速率相近,其目的是 ;装置C中浓硫酸的作用为 ;装置D中盛放的溶液中足量的 (选填字母)。
a.BaCl2溶液 b.NaOH溶液 c.NaHSO3饱和溶液
(4)停止通入SO2,熄灭酒精后,为使残留在装置中的SO2、SO3被充分吸收,操作方法是 。
(5)实验结束后,稀释装置C中的溶液,并向其中加入足量的BaCl2溶液,得到的沉淀质量为wg。若装置D增加的质量为ag,则此条件下二氧化硫的转化率是
(用含字母的代数表示,结果可不化简)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com