
| 序号 | 操作及现象 | 结论 |
| A | 将0.1mol•L-1氨水稀释成0.01mol•L-1,测得pH由11.1变成 10.6 | 稀释后NH3•H2O的电离程度增大 |
| B | 常温下,测得饱和Na2CO3溶液的pH大于饱和NaHCO3溶液 | 常温下水解程度:CO32->HCO3- |
| C | 向25mL冷水和沸水中分别滴入5滴FeCl3饱和溶液,前者为黄色,后者为红褐色 | 温度升高,Fe3+的水解程度增大 |
| D | 明矾可用于净水 | 明矾在水中水解生成的氢氧化铝胶体有吸附性 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.NH3•H2O为弱电解质,加水稀释促进电离;
B.Na2CO3溶解度较大,应比较相同的浓度的溶液的pH;
C.盐类的水解为吸热反应,升高温度促进水解;
D.氢氧化铝具有吸附性.
解答 解:A.NH3•H2O为弱电解质,加水稀释促进电离,由于溶液体积增大,pH反而减小,故A正确;
B.饱和溶液的浓度不同,Na2CO3溶解度较大,应比较相同的浓度的溶液的pH,故B错误;
C.盐类的水解为吸热反应,升高温度促进水解,可根据溶液颜色判断,故C正确;
D.明矾是强酸弱碱盐,铝离子能水解生成氢氧化铝胶体,胶体具有吸附性,所以能净水,故D正确.
故选B.
点评 本题考查较为综合,涉及弱电解质、盐类水解等知识,侧重于学生的分析能力和实验能力的考查,为高考常见题型,注意相关基本实验操作的注意事项,难度不大,注意相关基础知识的积累.


 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | CH3COONa | B. | KNO3 | C. | CuSO4 | D. | NaHCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Mg(NO3)2 | B. | NaNO3 | C. | AgNO3 | D. | Al(NO3)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
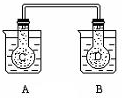 如图所示,在常况下容器A中盛有500mL蒸馏水,在容器B中盛有 500ml 1mol/L的盐酸,在烧瓶C和D中充满二氧化氮气体,并用导管将它们连通.向A容器中加入50g硝酸铵晶体,小心搅拌,使其迅速溶解;向B中加入10g苛性钠固体,小心搅拌也使其迅速溶解,随着A、B中固体物质的溶解,烧瓶C和D中气体的颜色变化是( )
如图所示,在常况下容器A中盛有500mL蒸馏水,在容器B中盛有 500ml 1mol/L的盐酸,在烧瓶C和D中充满二氧化氮气体,并用导管将它们连通.向A容器中加入50g硝酸铵晶体,小心搅拌,使其迅速溶解;向B中加入10g苛性钠固体,小心搅拌也使其迅速溶解,随着A、B中固体物质的溶解,烧瓶C和D中气体的颜色变化是( )| A. | 不变 | B. | 烧瓶C中颜色变深,D中变浅 | ||
| C. | 烧瓶D中变深,C中变浅 | D. | 两个烧瓶中的颜色都变深 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化钠在火焰上灼烧时使火焰呈黄色,是因为氯化钠发生了分解反应 | |
| B. | 用焰色反应可以鉴别KCl和KNO3 | |
| C. | 连续做两个样品时,应将铂丝用硫酸洗净并灼烧到无特殊焰色 | |
| D. | 如透过蓝色的钴玻璃能够观察到紫色火焰,则肯定有K元素,可能有Na元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
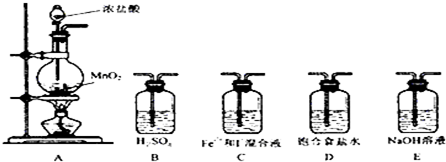
| 实验步骤 | 预期现象与结论 |
| 取少量反应的溶液置于A、B两支试管中; 向A试管中滴加KSCN; 向B试管中滴加淀粉: | ①若A变红色, B不变色则假设1成立 ②若A不变色, B变蓝色则假设2成立 ③若A变红色, B变蓝色则假设3成立 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com