
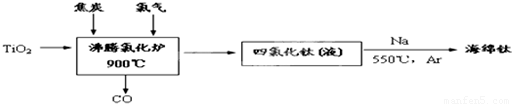
��10�֣���ҵ��ұ������Ҫ���������ʯ����TiO2����96������Ϊԭ��������
��1���ɽ��ʯΪԭ�ϲ��ú���(Hunter)�������ѵ��������£�
�ٷ����Ȼ�¯�з�Ӧ�Ļ�ѧ����ʽΪ��
����֪��Ti(s) +2Cl2(g) = TiCl4(l) ��H = ��804.2kJ/mol��
2Na(s) +Cl2(g)= 2NaCl(s) ��H = ��882.0kJ/mol
Na(s) =Na(l) ��H =2.6 kJ/mol
��д����Һ̬�������Ȼ����û����ѵ��Ȼ�ѧ����ʽ
�ۺ������������0.5%��1.5%������ϴ�ӣ���������ˮϴ�������ԣ�������ϴ�ӵ�Ŀ���� ��
��2����ѧ�Ҵӵ��ұ�����Ĺ��յõ��������ҳ���ұ���ѵ��¹��ա��Իش������й����⡣
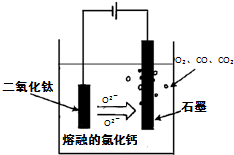
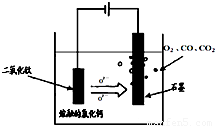
��TiO2ֱ�ӵ�ⷨ�����ŷ�����������һ�ֽ��Ƚ��ķ����������Ϊ���ڵ��Ȼ��ƣ�ԭ����ͼ��ʾ,������������ԭ��Ca��һ����ԭTiO2����ѣ����������������ķ�ӦΪ�� ��
��SOM������һ����ɫ�����Ƚ������������ý����մɣ����ù��������Ӹ�Ĥ���������������ֻ����������ͨ�����ڵ�����������ͨ��ij�ֻ�ԭ�����壬�ɷ�ֹCO��CO2��Ⱦ�������ͨ�����������H2����������ⷴӦʽΪ ��

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����

 ��������ѿ��ܷ����ķ�Ӧ��缫��ӦΪ��
��������ѿ��ܷ����ķ�Ӧ��缫��ӦΪ�� ������˵����ȷ����
������˵����ȷ�����鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�


�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ��ʴ���

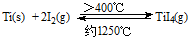
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2009-2010ѧ�꽭��ʡ�γ��и������ϣ����л�ѧ�Ծ��������棩 ���ͣ������
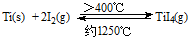 ������˵����ȷ����______��
������˵����ȷ����______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2011-2012ѧ��㶫ʡտ�����и߶����ϣ���ĩ��ѧ�Ծ������ƣ��������棩 ���ͣ������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com