
| A. | Na与H2O反应:Na+2H2O═Na++2OH-+H2 | |
| B. | Na与盐酸反应:2Na+2H+═2Na++H2↑ | |
| C. | 钠投入CuSO4溶液中:Cu2++2Na═Cu+2Na+ | |
| D. | Na与O2反应:4Na+O2═4Na++2O2- |
分析 A.2mol钠与水反应生成1mol氢气,该反应不满足电子守恒;
B.钠与盐酸反应生成氯化钠和氢气;
C.钠与硫酸铜溶液反应不会置换出铜,反应生成硫酸钠、氢气和氢氧化铜沉淀;
D.钠与氧气反应生成氧化钠,氧化钠不能拆开.
解答 解:A.Na与H2O反应生成氢氧化钠和氢气,正确的离子方程式为:2Na+2H2O═2Na++2OH-+H2↑,故A错误;
B.Na与盐酸反应生成氯化钠和氢气,反应的离子方程式为:2Na+2H+═2Na++H2↑,故B正确;
C.钠与硫酸铜溶液反应的化学方程式为:2Na+2H2O+CuSO4═Na2SO4+Cu(OH)2↓+H2↑,则离子方程式为:2Na+2H2O+Cu2+═2Na++Cu(OH)2↓+H2↑,故C错误;
D.Na与O2反应生成氧化钠,氧化钠需要保留化学式,该反应不存在离子方程式,正确的化学方程式为:4Na+O2═2Na2O,故D错误;
故选B.
点评 本题考查了离子方程式的正误判断,为高考的高频题,题目难度中等,注意掌握离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合守恒关系(如:质量守恒和电荷守恒等)等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2016-2017学年山西省高一上10月月考化学试卷(解析版) 题型:选择题
配制物质的量浓度为0.1 mol/L的Na2CO3溶液l00mL时,下列操作正确的是( )
A. 用托盘天平称取l.06g无水碳酸钠,在烧杯中加适量水溶解,待冷却到室温后,将溶液转移到容量瓶中
B. 定容时,若仰视,则所配溶液的浓度将偏高
C. 定容时,若加水超过刻度线,可用胶头滴管小心吸出多余部分
D. 在使用容量瓶前必须检查容量瓶是否完好以及瓶塞处是否漏水
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
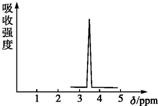 在有机物分子中,不同氢原子的核磁共振谱中给出的峰值(信号)也不同,根据峰值可以确定有机物分子中氢原子的种类和数目.
在有机物分子中,不同氢原子的核磁共振谱中给出的峰值(信号)也不同,根据峰值可以确定有机物分子中氢原子的种类和数目.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子化合物可能含共价键 | B. | 共价化合物不可能含离子键 | ||
| C. | 离子化合物中一定含离子键 | D. | 共价化合物中不含离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源:2016-2017学年山西省高一上10月月考化学试卷(解析版) 题型:选择题
下列叙述正确的是( )
A.物质的量是衡量物质质量大小的物理量
B.摩尔质量即相对分子质量
C.摩尔是物质的量的单位
D.气体摩尔体积是指单位物质的量的物质所占的体积
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com