
分析 (1)氯气和氢氧化钠溶液反应生成氯化钠、次氯酸钠和水;
(2)漂白粉或漂粉精的有效成分是次氯酸钙,使用漂白粉或漂粉精时通常要加入少量的水并通入CO2,利用碳酸酸性大于次氯酸,和次氯酸钙反应生成次氯酸,次氯酸具有氧化性、漂白性,可以杀菌消毒、漂白等作用;
解答 解:(1)在常温下,将氯气通入NaOH溶液中反应生成氯化钠、次氯酸钠和水,反应的化学方程式为:Cl2+2NaOH=NaCl+NaClO+H2O,
故答案为:Cl2+2NaOH=NaCl+NaClO+H2O;
(2)漂白粉或漂粉精的有效成分是次氯酸钙,使用漂白粉或漂粉精时通常要加入少量的水并通入CO2,利用碳酸酸性大于次氯酸,和次氯酸钙反应生成次氯酸,Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO,次氯酸具有氧化性、漂白性,可以杀菌消毒、漂白等作用
故答案为:Ca(ClO)2,使Ca(ClO)2转变为HClO,具有强氧化性,从而起到杀菌、消毒或漂白的作用;
点评 本题考查了氯气的性质等知识点,为高频考点,侧重于基础知识的考查,难度不大,注意次氯酸有强氧化性的强氧化性、不稳定以及漂白性的特点.


科目:高中化学 来源: 题型:选择题
| A. | 向50 mL 1 mol•L-1的盐酸中加入烧碱,水的KW不变 | |
| B. | NH4Cl和NH3•H2O混合液中,二者对对方的平衡都起了抑制作用 | |
| C. | 有两种弱酸HX和HY且酸性HX>HY,则体积和浓度相同的NaX和NaY溶液中有c(Y-)>c(X-)>c(OH-)>c(H+) | |
| D. | 常温下0.1mol•L-1的HA溶液中c(OH-)/c(H+)=10-8,则0.01 mol•L-1HA溶液中c(H+)=1×10-4mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用焰色反应鉴别NaCl、K2CO3 | |
| B. | 用氢氧化钠溶液鉴别MgCl2溶液和AlCl3溶液 | |
| C. | 利用丁达尔效应鉴别Fe(OH)3胶体与FeCl3溶液 | |
| D. | 用Ba(OH)2溶液鉴别Na2CO3和NaHCO3两种溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ③② | C. | ①②③ | D. | ③① |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
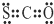
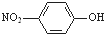
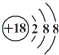

| A. | ①④⑤ | B. | ①②③④⑤ | C. | ③⑤⑥⑦ | D. | 全部正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
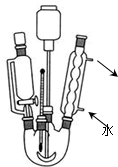
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 与NaOH反应的氯气一定为0.5 mol | |
| B. | 若反应中转移的电子数可能为$\frac{1}{3}$mol | |
| C. | 反应后的溶液中n(Na+)﹕n(Cl-)可能为7﹕6 | |
| D. | n(NaCl):n(NaClO):n(NaClO3)可能为11﹕2﹕3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com