
| A. | 0.1 mol/LCH3COONa溶液与0.1 mol/LCaCl2溶液等体积混合:c(Na+)+c(Ca2+)═c(CH3COO-)+c(CH3COOH)+2c(Cl- ) | |
| B. | 将等体积、等物质的量浓度的NH4HCO3与NaCl溶液混合,析出部分NaHCO3晶体后的溶液:c(H+)+c(H2CO3)═c(OH-)+c(CO32-)+c(NH3•H2O) | |
| C. | 0.1 mol/LCH3COONa溶液与0.1 mol/LHCl溶液混合至pH=7:c(Na+)>c(Cl-)=c(CH3COOH)>c(CH3COO-) | |
| D. | 0.2mol/L氨水与0.1 mol/LHCl溶液等体积混合:c(Cl-)+c(H+)═c(NH3•H2O)+c(OH-) |
分析 A.依据溶液中物料守恒分析判断;
B.溶液中存在电荷守恒:c(Na+)+c(H+)+c(NH4+)=c(OH-)+c(HCO3-)+2c(CO32-)+c(Cl-),溶液中存在物料守恒,即:c(Na)=c(Cl),c(NH4+)+c(NH3•H2O)=c(HCO3-)+c(CO32-)+c(H2CO3),计算分析判断;
C.0.1 mol/LCH3COONa溶液与0.1 mol/LHCl溶液混合至pH=7,依据溶液电荷守恒分析判断;
D.0.2mol/L氨水与0.1 mol/LHCl溶液等体积混合得到等浓度一水合氨和氯化铵溶液,一水合氨电离程度大于铵根离子水解溶液显碱性,溶液中存在电荷守恒和物料守恒计算分析.
解答 解:A.0.1 mol/LCH3COONa溶液中物料守恒c(Na+)=c(CH3COO-)+c(CH3COOH),0.1 mol/LCaCl2溶液中2c(Ca2+)=c(Cl- ),等体积混合c(Na+)+2c(Ca2+)=c(CH3COO-)+c(CH3COOH)+c(Cl- ),故A错误;
B.溶液中存在电荷守恒:c(Na+)+c(H+)+c(NH4+)=c(OH-)+c(HCO3-)+2c(CO32-)+c(Cl-),溶液中存在物料守恒,即:c(Na)=c(Cl),c(NH4+)+c(NH3•H2O)=c(HCO3-)+c(CO32-)+c(H2CO3),c(H+)+c(H2CO3)=c(OH-)+c(CO32-)+c(NH3•H2O),故B正确;
C.0.1 mol/LCH3COONa溶液与0.1 mol/LHCl溶液混合至pH=7,c(H+)=c(OH-),溶液中溶质为CH3COOH、CH3COONa、NaCl,存在电荷守恒得到c(CH3COO-)+c(Cl-)=c(Na+),c(CH3COO-)>c(Cl-)=c(CH3COOH),故C错误;
D.0.2mol/L氨水与0.1 mol/LHCl溶液等体积混合得到等浓度一水合氨和氯化铵溶液,一水合氨电离程度大于铵根离子水解溶液显碱性,溶液中存在电荷守恒为c(H+)+c(NH4+)=c(Cl-)+c(OH-),溶液中存在物料守恒2c(Cl-)=c(NH4+)+c(NH3•H2O),c(Cl-)+c(H+)-c(NH3•H2O)+c(OH-),故D正确;
故选BD.
点评 本题考查了电解质溶液中反应产物判断、电解质溶液中电荷守恒、物料守恒、质子守恒等知识点,掌握基础是解题关键,题目难度中等.


 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案科目:高中化学 来源: 题型:实验题
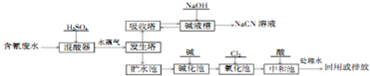
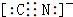 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:实验题
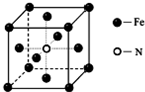 NH3在工农业生产中具有重要的作用,可以用来生产尿素等化学肥料,也可以用来制备一些配位化合物.
NH3在工农业生产中具有重要的作用,可以用来生产尿素等化学肥料,也可以用来制备一些配位化合物.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷分子的球棍模型: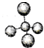 | B. | NH4Br的电子式: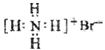 | ||
| C. | 氯原子的结构示意图: | D. | 邻羟基苯甲酸的结构简式: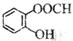 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

| 实验步骤 | 操作 | 现象与结论 |
| 第一步 | 取少量液体装于试管,向试管中滴入几滴KSCN溶液. | |
| 第二步 | 若溶液紫色褪去,则说明含有Fe2+; 若无明显变化,则说明不含Fe2+. |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
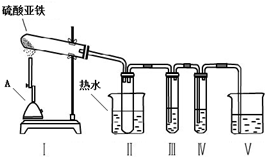
| 操作步骤 | 预期实验现象 | 预期实验结论 |
| 向其中一份溶液中加入 KSCN溶液(或B). | 溶液变成血红色 | 固体中含有Fe2O3 |
| 向另一份溶液中滴加 2滴黄色K3[Fe(CN)6]溶液. | 产生蓝色沉淀 | 固体中含有FeO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 产生的气体溶于水中,能使酚酞变红 | |
| B. | 催化剂保持红热 | |
| C. | 可能生成红棕色的气体 | |
| D. | 可能产生白烟 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com