


科目:高中化学 来源: 题型:
| A、NaCl溶液焰色反应呈黄色 |
| B、NH3能使湿润的红色石蕊试纸变蓝 |
| C、漂白粉的主要成分是次氯酸钙和氯化钙 |
| D、进行蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
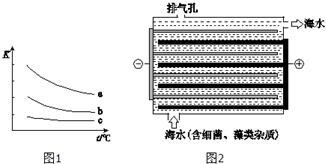 海水是巨大的化学资源宝库.
海水是巨大的化学资源宝库.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
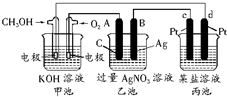 如图所示的装置中,甲池的总反应式为:2CH3OH+3O2+4KOH═2K2CO3+6H2O.
如图所示的装置中,甲池的总反应式为:2CH3OH+3O2+4KOH═2K2CO3+6H2O.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热 |
| B、蒸馏时,温度计水银球靠近蒸馏烧瓶的底部,且冷却水从冷凝管的下口通入上口流出 |
| C、分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 |
| D、称量时,将Na2CO3固体直接放在托盘天平的右盘上 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com