
分析 (1)NaCl为强酸强碱盐,溶液呈中性,NH4Cl为强酸弱碱盐,其溶液呈酸性,CH3COONa为强碱弱酸盐,其溶液呈碱性;
(2)氯化铁为强酸弱碱盐,水解呈酸性,配制溶液时应防止水解生成沉淀而使溶液变浑浊.
解答 解;(1)①NaCl为强酸强碱盐,溶液呈中性,②CH3COONa为强碱弱酸盐,其溶液呈碱性,③NH4Cl为强酸弱碱盐,其溶液呈酸性,故答案为:③;①;②;
(2)氯化铁为强酸弱碱盐,水解呈酸性,水解离子方程式为Fe3++3H2O?Fe(OH)3+3H+,配制溶液时应防止水解生成沉淀而使溶液变浑浊,则应加入盐酸,
故答案为:Fe3++3H2O?Fe(OH)3+3H+;抑制氯化铁的水解.
点评 本题考查了溶液pH的酸碱性、盐类水解的应用等知识点,为高频考点,侧重于学生的分析能力和基本理论知识的综合理解和运用的考查,难度不大.


科目:高中化学 来源: 题型:选择题
 和
和 两种结构式互为同分异构体(a、b为不同的原子或原子团),被称为烯烃的顺反异构,试推断一氯丙烯的同分异构体(不含环状结构)共有( )
两种结构式互为同分异构体(a、b为不同的原子或原子团),被称为烯烃的顺反异构,试推断一氯丙烯的同分异构体(不含环状结构)共有( )| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
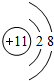 ,D元素位于周期表中的位置第三周期第ⅤⅡA族.
,D元素位于周期表中的位置第三周期第ⅤⅡA族.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 时间(min) | 5 | 10 | 15 | 20 | 25 | 30 |
| 压强比($\frac{{P}_{后}}{{P}_{前}}$) | 0.98 | 0.90 | 0.78 | 0.66 | 0.66 | 0.66 |
 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 有原子序数依次增大的A、B、C、D、E、F、G 七种元素,A 是短周期中族序数等于周期数的非金属元素;B 元素的原子既不易失去也不易得到电子,其基态原子中每种能级电子数相同;D 的最外层电子数与电子层数之比为3:1;E是地壳中含量第二多的非金属元素;D、F同族; G 元素原子序数为24.
有原子序数依次增大的A、B、C、D、E、F、G 七种元素,A 是短周期中族序数等于周期数的非金属元素;B 元素的原子既不易失去也不易得到电子,其基态原子中每种能级电子数相同;D 的最外层电子数与电子层数之比为3:1;E是地壳中含量第二多的非金属元素;D、F同族; G 元素原子序数为24.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 离子组 | 加入试剂(溶液) | 加入试剂后发生反应的离子方程式 |
| A | SO42-、Fe2+、NO3-、K+ | K3[Fe(CN)6] | 3Fe2++2[Fe(CN)6]3-=Fe3[Fe(CN)6]2↓ |
| B | Na+、Fe3+、I-、ClO- | HCl | ClO-+H+=HClO |
| C | Ba2+、Al3+、Cl-、H+ | 少量NaOH | Al3++3OH-=Al(OH)3↓ |
| D | S2O32-、Na+、Cl-、SO32-、K+ | 过量硫酸 | 2S2O32-+2H+=SO42-+3S↓+H2O |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用氨水鉴别MgCl2溶液和AlCl3溶液 | |
| B. | 用二氧化碳鉴别CaCl2溶液和NaCl溶液 | |
| C. | 用铁片鉴别稀H2SO4和浓H2SO4 | |
| D. | 用相互滴加的方法鉴别NaHCO3溶液和Ca(OH)2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | s区元素都是金属元素 | B. | p区元素全部都是非金属元素 | ||
| C. | d区、ds区和f区由副族元素组成 | D. | s区和p区由主族和0族元素组成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+<Mg2+<Al3+<K+ | B. | S2->Cl->K+>Ca2+ | ||
| C. | O2->S2->Cl->Br- | D. | F->Li+>Na+>S2- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com