
已知:(1)H2(g)+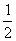 O2(g)====H2O(g) ΔH1= a kJ·mol-1
O2(g)====H2O(g) ΔH1= a kJ·mol-1
(2)2H2(g)+O2(g)====2H2O(g) ΔH2= b kJ·mol-1
(3)H2(g)+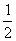 O2(g)====H2O(l) ΔH3= c kJ·mol-1
O2(g)====H2O(l) ΔH3= c kJ·mol-1
(4)2H2(g)+O2(g)====2H2O(l) ΔH4= d kJ·mol-1
下列关系式正确的是( )
A.a<c<0 B.b>d>0 C.2a=b<0 D.2c=d>0
科目:高中化学 来源: 题型:
把下列四种X溶液,分别加入四个盛有10mL2mol·L-1盐酸的烧杯中,均加水稀释到50mL,此时X和盐酸能缓慢地进行反应。其中反应速率最大的是( )
A、20mL3mol·L-1的X溶液
B、20mL2mol·L-1的X溶液
C、10mL4mol·L-1的X溶液
D、10mL2mol·L-1的X溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
按要求完成下列各题。
(1)PbO2与浓盐酸共热生成黄绿色气体,反应的化学方程式为: 。
(2)ClO2常用子水的净化,工业上可用Cl2氧化NaClO2溶液制取ClO2。写出该反应的离子方程式: 。
(3)MnO2可与KOH和KClO3在高温条件下反应,生成K2MnO4,反应的化学方程式为: 。K2MnO4在酸性溶液中歧化,生成KMnO4和MnO2的物质的量之比为 。
(4)(CN)2称为拟卤素,性质与卤素相似,其与氢氧化钠溶液反应的化学方程式为
。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述Ⅰ和Ⅱ均正确并且有因果关系的是
| 选项 | 叙述I | 叙述II |
| A | SiO2可与HF反应 | 氢氟酸不能保存在玻璃瓶中 |
| B | Fe3+具有氧化性 | 用KSCN溶液可以鉴别Fe3+ |
| C | 溶解度:CaCO3<Ca(HCO3)2 | 溶解度:Na2CO3<NaHCO3 |
| D | NH4Cl为强酸弱碱盐 | 加热可除去NaCl中的NH4Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:
家用液化气中的主要成分之一是丁烷,当10 kg丁烷完全燃烧并生成二氧化碳和液态水时,放出热量为5×105 kJ,试写出丁烷燃烧反应的热化学方程式__________________________。
已知1 mol液态水汽化时需要吸收44 kJ的热量,则1 mol丁烷完全燃烧并生成气态水时放出的热量为_______________kJ。
查看答案和解析>>
科目:高中化学 来源: 题型:
黄铁矿(主要成分为FeS2)是我国大多数硫酸厂制取的主要原料。某化学学习小组对某黄铁矿石进行如下实验探究。
[实验一] 测定硫元素的含量
Ⅰ.将m1 g该黄铁矿样品放入如下图所示装置(夹持和加热装置省略)的石英管中,从a处持续不断地缓缓通入空气,高温灼烧石英管中的黄铁矿样品至反应完全。
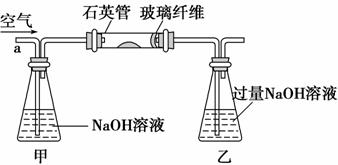
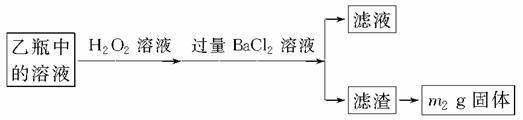
Ⅱ.反应结束后,将乙瓶中的溶液按下述流程进行处理。

[实验二] 测定铁元素的含量
Ⅲ.测定铁元素含量的实验步骤如下:
①用足量稀硫酸溶解石英管中的固体残渣;
②加还原剂使溶液中的Fe3+完全转化为Fe2+后,过滤、洗涤;
③将滤液稀释 至250 mL;
至250 mL;
④每次取稀释液25.00 mL,用物质的量浓度为c mol·L-1的酸性KMnO4溶液滴定。三次滴定实验所需KMnO4溶液体积的平均值为V mL(该反应中还原产物为Mn2+)。
请完成下列问题:
(1)已知12 g FeS2完全燃烧放热85.3 kJ,则表示FeS2燃烧热的热化学方程式是_______________________________________________________________________。
(2)Ⅰ中乙瓶内发生反应的离子方程式有_______________________________________________________________________。
Ⅰ中玻璃纤维的作用是_______________________________________________。
(3)Ⅱ中的滤渣在称量前还应进行的操作是_______________________________。
(4)Ⅲ的步骤③中,需要用到的仪器除烧杯、玻璃棒、量筒、胶头滴管外,还有________________。
(5) 该黄铁矿中铁元素的质量分数________________(用Ⅰ、Ⅲ中有关实验数据表达)。
该黄铁矿中铁元素的质量分数________________(用Ⅰ、Ⅲ中有关实验数据表达)。
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)分子式为C4H10O并能与金属钠反应放出H2的有机化合物有________种。
(2)与化合物C7H10O2互为同分异构体的物质不可能为________。
A.醇 B.醛
C.羧酸 D.酚
(3)与具有相同官能团的同分异构体的结构简式为___________________。
(4)苯氧乙酸( )有多种酯类的同分异构体。其中能与FeCl3溶液发生显色反应,且苯环上有2种一硝基取代物的同分异构体是________________________________________________________________________
)有多种酯类的同分异构体。其中能与FeCl3溶液发生显色反应,且苯环上有2种一硝基取代物的同分异构体是________________________________________________________________________
________________________________________________________________________
_________________________________________________(写出任意2种的结构简式)。
(5)分子式为C5H10的烯烃共有(不考虑顺反异构)________种。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com