
下列各物质溶解于水时,电离出的阴离子能使水的电离平衡向右移动的是( )
A.CH3COOH B.Na2SO4 C.NH4Cl D.HF
科目:高中化学 来源: 题型:阅读理解
| 阳离子 | Ba2+ NH4+ Fe3+ Al3+ Fe2+ |
| 阴离子 | OH- CO32- Cl- SO32- SO42- |
| ||
| ||
查看答案和解析>>
科目:高中化学 来源:2013-2014学年安徽省高一上学期期中考试化学试卷(解析版) 题型:选择题
有A、B、C三种可溶性正盐,阴、阳离子各不相同,其阴离子的摩尔质量依次增大(按A、B、C的顺序),将等物质的量的A、B、C溶于水,所得溶液中只含有Fe3+、K+、SO42-、NO3-、Cl-五种离子(不考虑难溶物自身的溶解),同时生成一种阴、阳离子个数比为1:1的白色沉淀。请回答下列问题:
(1)经检验,三种正盐中还含有下列选项中的一种离子,该离子是________.
A.Na+ B.Mg2+ C.Cu2+ D.Ag+
(2)三种正盐的化学式分别是:A ,B ,C
(3) A、B、C同时溶于水时反应的离子方程式为
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
| 阳离子 | Ba2+ NH4+ Fe3+ Al3+ Fe2+ |
| 阴离子 | OH- CO32- Cl- SO32- SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
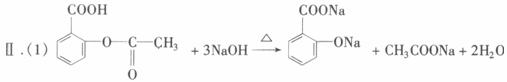
已知:①阿司匹林药片中一般添加少量的辅料(都不溶于水,也不与NaOH反应);②酚类物质与FeCl3溶液在弱酸性条件下能发生显色反应。
某课外学习小组为检验阿司匹林有效成分中的官能团并测定乙酰水杨酸在药片中的含量,进行了如下实验:
Ⅰ.验证乙酰水杨酸中具有羧基和酯的结构(—COOR)。
①将一片阿司匹林研碎后溶于水,静置,各取清液2 mL于两支洁净的试管中;
②向一支试管中加入_________,若观察到__________________,即证明乙酰水杨酸中有羧基;
③向另一支试管中加入适量NaOH溶液,加热几分钟,冷却后逐滴入稀H2SO4,再向其中滴入FeCl3溶液,边加边振荡,若观察到溶液逐渐变为_________色,即证明乙酰水杨酸中具有酯的结构。
回答下列问题:
(1)将上述三处空白补充完整。
(2)实验中滴加稀H2SO4的作用是__________________。
Ⅱ.该学习小组设计了如下实验方案测定乙酰水杨酸在药片中的含量:
①称取阿司匹林样品m g;
②将样品研碎,溶于V1 mL a mol·L-1 NaOH溶液(过量)并加热,除去辅料等不溶物,将所得溶液移入锥形瓶;
③向锥形瓶中滴加几滴指示剂,用浓度为b mol·L-1的标准盐酸返滴未反应的NaOH,消耗盐酸的体积为V2 mL。
回答下列问题:
(1)阿司匹林中加入过量NaOH溶液并加热时发生反应的化学方程式为__________________;其中,加热的目的是__________________________________________。
(2)不能将阿司匹林溶解于水后直接用NaOH溶液进行滴定的原因是_____________________
____________________________________________________________________。
(3)根据实验中记录的数据,阿司匹林药片中乙酰水杨酸质量分数的表达式为_____________
_____________________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com