
| A.棕红色的二氧化氮加压后颜色先变深后变浅 |
| B.由氢气、碘蒸气、碘化氢气体组成的平衡体系加压后颜色变深 |
| C.加入铁触媒作催化剂有利于氨的合成 |
| D.黄绿色的氯水光照后颜色变浅 |
科目:高中化学 来源:不详 题型:单选题
| A.加入催化剂有利于氨氧化反应 |
| B.使氢硫酸中加碱有利于S2-离子增多 |
| C.500℃左右比室温更有利于合成氨反应 |
| D.高压条件有利于合成氨 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
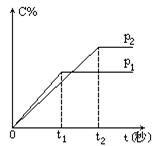
 nC(气)
nC(气)| A.p1>p2 n<3 |
| B.p1<p2 n>3 |
| C.p1<p2 n=3 |
| D.p1>p2 n>3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2C(气)+Q的平衡体系,下列说法错误的是
2C(气)+Q的平衡体系,下列说法错误的是 查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
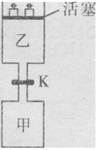
 .1min时反应达平衡状态,有3/4的SO2转化为SO3. 在800℃时,向乙中充入2molSO3.起始时,甲、乙的体积均为1L。下列说法正确的是( )
.1min时反应达平衡状态,有3/4的SO2转化为SO3. 在800℃时,向乙中充入2molSO3.起始时,甲、乙的体积均为1L。下列说法正确的是( )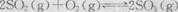 的平衡常数为24
的平衡常数为24查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
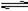 2NH3(g)△H<0。在某一时间段t0~t6中反应速率与反应过程的曲线图。试回答下
2NH3(g)△H<0。在某一时间段t0~t6中反应速率与反应过程的曲线图。试回答下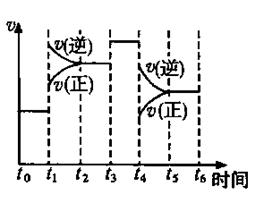
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
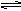 2NH3(g),N2、H2起始分别为10mol、30mol,达平衡时H2的转化率为25%,若从NH3开始反应,在相同条件下,欲使平衡时各成分的体积分数与前者相同,则起始时NH3的物质的量及NH3的转化率为( )
2NH3(g),N2、H2起始分别为10mol、30mol,达平衡时H2的转化率为25%,若从NH3开始反应,在相同条件下,欲使平衡时各成分的体积分数与前者相同,则起始时NH3的物质的量及NH3的转化率为( ) | A.15mol;25% | B.20mol;50% | C.20mol;75% | D.40mol;80% |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.不断将氨分离出来 | B.使用催化剂 |
| C.采用500℃左右的高温 | D.采用2×107~5×107Pa的压强 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

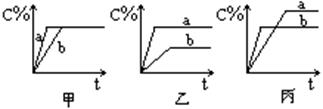
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com