
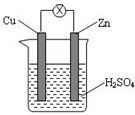
| A. | Zn 是负极,发生还原反应 | B. | Cu 是负极,发生氧化反应 | ||
| C. | Cu 片上有气体逸出 | D. | 电子由 Cu 片通过导线流向 Zn 片 |
分析 该装置是将化学能转化为电能的装置,为原电池,Zn易失电子作负极、Cu作正极,电子从负极沿导线流向正极,据此分析解答.
解答 解:A.该装置是原电池,Zn易失电子发生氧化反应而作负极、Cu作正极,故A错误;
B.Cu作正极,发生还原反应,故B错误;
C.铜是正极,氢离子在正极得电子发生还原反应:2H++2e-=H2↑,故C正确;
D.负极上失电子、正极上得电子,该装置中Zn是负极、Cu是正极,所以电子从Zn沿导线流向正极Cu,故D错误;
故选C.
点评 本题考查原电池原理,为高频考点,明确原电池概念、正负极判断、电子流向是解本题关键,注意电解质溶液中阴阳离子移动方向,电子不进入电解质溶液,为易错点.


 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A>B>C>D | B. | C>A>D>B | C. | A>C>D>B | D. | B>D>C>A |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
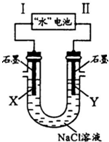 研究人员发现了一种“水”电池,其总反应为:5MnO2+2Ag+2NaCl=Na2Mn5O10+2AgCl.如图用“水”电池为电源电解NaCl溶液的实验中,X电极上有无色气体逸出.下列有关分析正确的是( )
研究人员发现了一种“水”电池,其总反应为:5MnO2+2Ag+2NaCl=Na2Mn5O10+2AgCl.如图用“水”电池为电源电解NaCl溶液的实验中,X电极上有无色气体逸出.下列有关分析正确的是( )| A. | I为负极,其电极反应式为Ag+Cl-+e-=AgCl | |
| B. | “水”电池内Na+不断向负极作定向移动 | |
| C. | 每转移1 mol e-,U型管中消耗0.5 mol H2O | |
| D. | “水”电池内,每生成1 mol Na2Mn5O10,X电极上生成1 mol气体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com