原子序数由小到大排列的四种短周期元素X、Y、Z、W,四种元素的原子序数之和为32,在周期表中X是原子半径最小的元素,则X为氢元素;Y、Z左右相邻,Z、W位于同主族,原子序数Y<Z<W,则三者的相对位置为
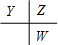
,令Y的原子序数为a,则Z的原子序数为a+1,W的原子序数为a+9,所以a+a+1+a+9=32-1,解得a=7,故X为氢元素,Y为氮元素,Z为氧元素,W为硫元素.
(1)W为硫元素,原子核外有16个电子,有3个电子层,最外层电子数为6,位于周期表中第三周期第VⅠA族; Y为氮元素,原子核外有7个电子,核外电子排布式为1S
22S
22P
3,氮原子价电子排布式 2S
22P
3.
故答案为:第三周期第VⅠA族; 2S
22P
3.
(2)X为氢元素,Y为氮元素,由X、Z两元素可以组成A、B两种化合物,A在一定条件下可以分解成B,则A为N
2H
4,B为NH
3,N
2H
4分子中氮原子与氮原子之间形成N-N单键,每个N原子还形成2个N-H键,N原子有1对孤对电子对,N原子的杂化轨道数为4,N原子采取sp
3杂化,呈三角锥,两个-NH
2分别位于类似打开书页的页面内,与过氧化氢类似,分子不对称,为极性分子.
故答案为:极性.
(3)X为氢元素,Y为氮元素,一定条件下,Y的单质气体与X的单质气体充分反应生成6.8g C气体,可放出18.44kJ热量,C为NH
3,6.8gNH
3的物质的量为
=0.4mol,所以生成2molNH
3,放出的热量为18.44kJ×
=92.2kJ,则该反应的热化学方程式为N
2(g)+3H
2(g)

2NH
3 (g)△H=-92.2 kJ/mol.
故答案为:N
2(g)+3H
2(g)

2NH
3 (g)△H=-92.2 kJ/mol.
(4)由X、Y、Z、W四种元素组成的一种离子化合物D,则D为硫酸形成的铵盐或亚硫酸形成的铵盐.
①D为硫酸形成的铵盐或亚硫酸形成的铵盐,1mol D能与足量NaOH浓溶液反应生成标准状况下44.8L气体,该气体为氨气,物质的量为2mol,则D为硫酸铵或亚硫酸铵,加热条件下D与NaOH溶液反应的离子方程式为NH
4++OH
- H
2O+NH
3↑.
故答案为:NH
4++OH
- H
2O+NH
3↑.
②D既能与盐酸反应,又能与氯水反应,结合①可知D为亚硫酸铵,Cl
2将SO
32-氧化为SO
42-,自身被还原为Cl
-,
反应的离子方程式为SO
32-+Cl
2+H
2O═SO
42-+2Cl
-+2H
+.
故答案为:SO
32-+Cl
2+H
2O═SO
42-+2Cl
-+2H
+.
(5 )氢气与氧气在KOH的浓溶液中可以形成原电池,如果以金属M和金属N为惰性电极,在电池的M极通入X的单质气体,N极通入Z的单质气体,原电池负极发生氧化反应,则氢气在负极放电,正极反应还原反应,则氧气在正极放电,所以M极通氢气,N极通氧气,碱性条件下,氢气放电生成水,则M极的电极反应式为 H
2+2OH
--2e
-═2 H
2O.
故答案为:H
2+2OH
--2e
-═2 H
2O.





 名校课堂系列答案
名校课堂系列答案 H2SO3、H2SO3
H2SO3、H2SO3 H++HSO3-
H++HSO3- H2SO3、H2SO3
H2SO3、H2SO3 H++HSO3-
H++HSO3-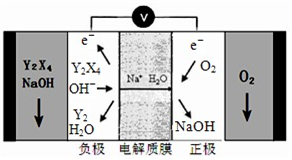
 X、Y、Z、W为按原子序数由小到大排列的四种短周期元素.已知:①X可分别与Y、W形成X2Y,X2Y2、XW等共价化合物;②Z可分别与Y、W形成Z2Y、Z2Y2、ZW等离子化合物.
X、Y、Z、W为按原子序数由小到大排列的四种短周期元素.已知:①X可分别与Y、W形成X2Y,X2Y2、XW等共价化合物;②Z可分别与Y、W形成Z2Y、Z2Y2、ZW等离子化合物.