
| 1 |
| 2 |
| A、原子半径:W>Z>Y>X>M |
| B、化合物Y2M4、M2Z2均只含有极性键 |
| C、最高价氧化物对应水化物的酸性:Y>X |
| D、由X、Y、Z、M四种元素形成的化合物一定既有离子键,又有共价键 |
| 1 |
| 2 |
| 6+7+8+1 |
| 2 |
| 1 |
| 2 |
| 6+7+8+1 |
| 2 |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| A、滴人甲基橙显红色的溶液中:NH4+、Ba2+、AlO-2、Cl- | ||||
B、Kw/c(H+)=0.1 mol/L的溶液:Na+、K+、Si
| ||||
C、含有较多S
| ||||
D、澄清透明溶液中:K+、Mn
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、pH=0的溶液中:Fe3+、Mg2+、Cl-、SO42- |
| B、水电离出的c(H+)=1×10-13mol/L的溶液中:K+、HCO3-、Cl-、S2- |
| C、使紫色石蕊试液显蓝色的溶液中:Mg2+、NO3-、Fe3+、SO42- |
| D、溶有碳酸氢钠的溶液:K+、SO42-、Cl-、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Fe3O4溶于足量稀HNO3:Fe3O4+8H+═Fe2++2Fe3++4H2O |
| B、NH4HCO3溶液与足量Ba(OH)2溶液混合:HCO3-+Ba2++OH-═BaCO3↓+H2O |
| C、向澄清石灰水中通入少量CO2:OH-+CO2═HCO3- |
| D、将0.2 mol?L-1的NH4Al(SO4)2溶液与0.3 mol?L-1的Ba(OH)2溶液等体积混合:2Al3++3SO42-+3Ba2++6OH-═2Al(OH)3↓+3BaSO4↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.012kg12C中含有约6.02×1023个碳原子 |
| B、1molH2O中含有2 mol氢和1mol氧 |
| C、氢氧化钠的摩尔质量是40g |
| D、2mol水的摩尔质量是1mol水的摩尔质量的2倍 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、一定温度下,pH=6的纯水中含有OH-的数目为10-6 NA |
| B、120 g NaHSO4固体中含有的离子总数为2NA |
| C、标准状况下,22.4 L己烷中所含分子的数目为NA |
| D、100 mL 0.5 mol?L-1 的(NH4)2SO4 溶液中,NH4+的数目为 0.1 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
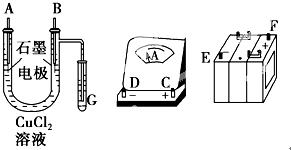 某学生试图用电解法根据电极上析出物质的质量来验证阿伏加德罗常数值,其实验方案的要点为:
某学生试图用电解法根据电极上析出物质的质量来验证阿伏加德罗常数值,其实验方案的要点为:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、只有①②③ | B、只有②③⑤ |
| C、只有③ | D、只有②④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 砝码质量/g | 50 | 20 | 20 | 10 | 5 |
| 称量(取用砝码过程) |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com