
| t1~t2 | t2~t3 | t3~t4 | t4~t5 | t5~t6 |
| K1 | K2 | K3 | K4 | K5 |
 3C(g)△H=+200a kJ/mol
3C(g)△H=+200a kJ/mol分析 (1)①根据v=$\frac{△c}{△t}$计算v(C);
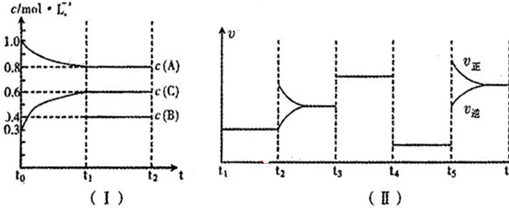
②图Ⅱ是在四种不同情况下影响化学的平衡,而影响平衡的因素有:浓度、温度、压强、催化剂;t3~t4和t4~t5这两段平衡是不移动的,则只能是压强和催化剂影响的,因此应该推断该反应为等体积变化的反应,t3~t4的平衡比原平衡的速率要快,而t4~t5的速率又变慢,则前者应是加催化剂,因为条件只能用一次,t4~t5段为减压;反应物的浓度降低,生成物的浓度增大,结合图Ⅰ可知,A为反应物,C为生成物,A的变化为0.2mol/L,C的变化量为0.3mol/L.又由于该反应为等体积变化的反应,所以B为反应物,根据化学反应的速率之比等于化学方程式前的计量系数比,写出该反应的方程式为2A(g)+B(g) 3C(g),起始2molA所对应的浓度为1mol/L,则体积应是2L,t5-t6 阶段为升高温度,v(正)>(逆),平衡向正反应方向移动,升高温度平衡向吸热方向移动;根据平衡常数,平衡移动解答K1、K2、K3、K4、K5之间的关系;
3C(g),起始2molA所对应的浓度为1mol/L,则体积应是2L,t5-t6 阶段为升高温度,v(正)>(逆),平衡向正反应方向移动,升高温度平衡向吸热方向移动;根据平衡常数,平衡移动解答K1、K2、K3、K4、K5之间的关系;
③依据热化学方程式的书写方法和焓变计算得到热化学方程式;
(2)①锰离子有催化作用;
②要想验证锰离子的催化作用,再加入硫酸锰即可.
解答 解:(1)①15min内,以C浓度变化表示的反应速率为v(C)=$\frac{0.6mol/L-0.3mol/L}{30min}$=0.01 mol/(L•min),故答案为:0.01 mol/(L•min);
②t3~t4和t4~t5这两段平衡是不移动的,则只能是压强和催化剂影响的,因此应该推断该反应为等体积变化的反应,t3~t4的平衡比原平衡的速率要快,而t4~t5的速率又变慢,则前者应是加催化剂,因为条件只能用一次,t4~t5段为减压.反应物的浓度降低,生成物的浓度增大,结合图Ⅰ可知,A为反应物,C为生成物,A的变化为0.2mol/L,C的变化量为0.3mol/L.又由于该反应为等体积变化的反应,所以B为反应物,根据化学反应的速率之比等于化学方程式前的计量系数比,该反应的方程式为2A(g)+B(g) 3C(g),所以,△c(B)=$\frac{1}{2}$△n(A)=$\frac{1}{2}$×0.2mol/L=0.1mol/L,故B的起始物质的量浓度为c(B)=0.1mol/L+0.4mol/L=0.5mol/L,t2-t3段,为改变浓度,平衡移动,平衡常数不变,
3C(g),所以,△c(B)=$\frac{1}{2}$△n(A)=$\frac{1}{2}$×0.2mol/L=0.1mol/L,故B的起始物质的量浓度为c(B)=0.1mol/L+0.4mol/L=0.5mol/L,t2-t3段,为改变浓度,平衡移动,平衡常数不变,
t3-t4段,使用催化剂,加快反应,平衡常数不变,
t4-t5段,为降低压强,反应速率降低,平衡不移动,平衡常数不变,
t5-t6段,为升高温度,平衡向正反应方向移动,平衡常数增大,
故 K1=K2=K3=K4<K5,
故答案为:减小压强;0.5mol/L; K1=K2=K3=K4<K5;
③根据方程式计算,若A的物质的量共变化了0.01mol,而此过程中容器与外界的热交换总量为a kJ,则反应2molA时,交换热量200akJ,而由图象可知,t5~t6阶段应为升高温度,正反应速率大于逆反应速率,平衡向正反应方向移动,则正反应为吸热反应,所以热化学方程式为2A(g)+B(g)  3C(g)△H=+200a kJ/mol,故答案为:2A(g)+B(g)
3C(g)△H=+200a kJ/mol,故答案为:2A(g)+B(g)  3C(g)△H=+200a kJ/mol;
3C(g)△H=+200a kJ/mol;
(2)KMnO4与H2C2O4反应生成硫酸锰,锰离子有催化作用,所以猜想还可能是催化剂的作用,
故答案为:硫酸锰或Mn2+的催化作用;
(4)要想验证锰离子的催化作用,在做对比实验时同时加入硫酸锰观察反应速率是否变化即可,
故选B.
点评 本题以图象的形式考查影响化学反应速率、化学平衡移动的因素、探究影响化学反应速率的因素等知识,题目难度中等.


 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案科目:高中化学 来源: 题型:解答题

| 时间/min | 0 | 20 | 70 | 80 | 100 |
| n(CO2)/mol | 0.10 | 0.060 | 0.020 | 0.020 | 0.020 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 配位体是Cl-和H2O,配位数是9 | |
| B. | 中心离子是Ti4+,配离子是[TiCl(H2O)5]2+ | |
| C. | 内界和外界中的Cl-的数目比是1:2 | |
| D. | 加入足量AgNO3溶液,所有Cl-均被完全沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 增大N2浓度可以增大反应速率 | |
| B. | 增大H2浓度可以使N2转化率达到100% | |
| C. | 升高温度可以加快反应速率 | |
| D. | 高压条件可以加快反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 20% | B. | 33.3% | C. | 50% | D. | 75% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同一化学反应中用各反应物及各生成物表示的速度相等 | |
| B. | 无论何种反应,在其它条件不变的情况下,升温速度则加快 | |
| C. | 无论何种反应改变压强就能改变其速度 | |
| D. | 用单位时间内某物质浓度的改变量所表示的速度是即时速度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氨水能跟氯化亚铁溶液反应生成氢氧化亚铁 | |
| B. | 0.1mol/L氯化铵溶液的pH约为5 | |
| C. | 0.1mol/L氨水可以使酚酞试液变红 | |
| D. | 铵盐受热易分解 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com