

| A. | 正极反应为AgCl+e-═Ag+Cl- | |
| B. | 放电时,交换膜右侧溶液中有大量白色沉淀生成 | |
| C. | 若用NaCl溶液代替盐酸,则电池总反应随之改变 | |
| D. | 当电路中转移0.01 mol e-时,交换膜左侧溶液中约减少0.02 mol离子 |
分析 根据电池总反应为2Ag+Cl2═2AgCl可知,Ag失电子作负极失电子,氯气在正极上得电子生成氯离子,
A.正极上氯气得电子;
B.放电时,交换膜左侧银为负极失电子形成银离子与溶液中的氯离子结合成AgCl沉淀;
C.根据电池总反应判断;
D.放电时,交换膜左侧溶液中生成银离子.
解答 解:根据电池总反应为2Ag+Cl2═2AgCl可知,Ag失电子作负极失电子,氯气在正极上得电子生成氯离子,
A.正极上氯气得电子生成氯离子,其电极反应为:Cl2+2e-═2Cl-,故A错误;
B.放电时,交换膜左侧银为负极失电子形成银离子与溶液中的氯离子结合成AgCl沉淀,所以左侧溶液中有大量白色沉淀氯化银生成,故B错误;
C.根据电池总反应为2Ag+Cl2═2AgCl可知,用NaCl溶液代替盐酸,电池的总反应不变,故C错误;
D.放电时,当电路中转移0.01mol e-时,交换膜左则会有0.01mol氢离子通过阳离子交换膜向正极移动,同时会有0.01molAg失去0.01mol电子生成银离子,银离子会与氯离子反应生成氯化银沉淀,所以氯离子会减少0.01mol,则交换膜左侧溶液中共约减少0.02mol离子,故D正确;
故选D.
点评 本题考查了原电池原理的应用及沉淀反应,注意把握原电池原理及正负极的判断和电极方程式的书写,利用电子及电荷守恒来解决原电池中有关计算的问题,题目难度中等.


科目:高中化学 来源: 题型:解答题
 氨基甲酸铵是一种用途广泛的化工原料.有关它的资料如下:
氨基甲酸铵是一种用途广泛的化工原料.有关它的资料如下: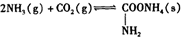
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 氢氧燃料电池是符合绿色化学理念的新型发电装置,如图为电池示意图,下列有关氢氧燃料电池的说法正确的是( )
氢氧燃料电池是符合绿色化学理念的新型发电装置,如图为电池示意图,下列有关氢氧燃料电池的说法正确的是( )| A. | 该电池工作时电能转化成化学能 | |
| B. | 该电池中a是正极 | |
| C. | 外电路中的电子由电极b通过导线流向a | |
| D. | 该电池的总反应为:2H2+O2═2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | Cu2+ K+ Na+ SO42- | B. | K+ Na+ Cl-HCO3- | ||
| C. | Cl- NO3- Mg2+ NH4+ | D. | NO3- Na+ Cl-K+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 增加Fe的量 | |
| B. | 将容器的容积缩小一半 | |
| C. | 保持容积不变,充入N2使体系压强增大 | |
| D. | 压强不变,充入N2使容器容积增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、H+、NO3-、SiO32- | B. | H+、NH4+、Al3+、SO42- | ||
| C. | Fe2+、H+、ClO-、SO42- | D. | AlO2-、Mg2+、HCO3-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 序号 | 实验步骤 | 肯定不存在的离子 |
| ① | 用pH试纸测得该溶液呈酸性 | |
| ② | 另取10mL该溶液,逐滴加入稀NaOH溶液,使溶液从酸性逐渐变为碱性,在整个滴加过程中无沉淀生成 | |
| ③ | 往②所得溶液中加入足量Na2CO3溶液,过滤、洗涤、干燥,得到1.97g白色固体 | |
| ④ | 另取10mL该溶液,加入浓NaOH溶液并加热,收集到224mL,气体(标准状况) | |
| ⑤ | 另取10mL该溶液,加入足量稀HNO3和AgNO3,产生2.87g白色沉淀 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com