
【题目】以下叙述不正确的是( )
A.化学反应必然伴随发生能量变化
B.人体运动所消耗的能量与化学反应有关
C.在化学反应中,反应物的总能量总是高于生成物的总能量
D.煤、石油、天然气是当今世界最重要的三种化石燃料
科目:高中化学 来源: 题型:
【题目】25℃时,用0.0500molL﹣1H2C2O4(二元弱酸)溶液滴定25.00mL0.1000molL﹣1NaOH溶液所得滴定曲线如图.下列说法正确的是( ) 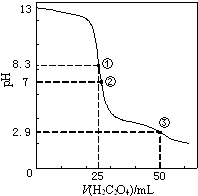
A.点①所示溶液中:c(H+)+c(H2C2O4)+c(HC2O4﹣)=c(OH﹣)
B.点②所示溶液中:c(HC2O4﹣)+2c(C2O42﹣)=c(Na+)+c(H+)
C.点③所示溶液中:c(Na+)>c(HC2O4﹣)>c(H2C2O4)>c(C2O42﹣)
D.滴定过程中可能出现:c(Na+)>c(C2O42﹣)=c(HC2O4﹣)>c(H+)>c(OH﹣)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学方程式中,不能用H++OH-=H2O表示的是
A. 2NaOH+H2SO4 =Na2SO4+2H2O B. Ba(OH)2+2HCl=BaCl2+2H2O
C. Cu(OH)2+2HNO3=Cu(NO3)2+2H2O D. KOH+HCl=KCl+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】120 ℃条件下,一定质量的某有机物(只含C、H、O三种元素中的两种或三种)在足量O2中燃烧后,将所得气体先通过浓H2SO4,浓H2SO4增重2.7 g,再通过碱石灰,碱石灰增重4.4 g,对该有机物进行核磁共振分析,谱图如下图所示:

则该有机物可能是( )
A. CH3CH3 B. CH3CH2COOH
C. CH3CH2OH D. CH3CH(OH)CH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按如图装置,持续通入X气体,可以看到a处有红色物质生成,b处变蓝,c处得到液体,则X气体是

A. H2 B. CH3CH2OH(气) C. CO2 D. CO和H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯是重要的化工原料,用CO2催化加氢可制取乙烯:2CO2(g)+6H2(g)![]() C2H4(g)+4H2O(g) △H<0
C2H4(g)+4H2O(g) △H<0
(1)若该反应体系的能量随反应过程变化关系如图所示,则该反应的△H=_______kJ/mol (用含a、b的式子表示)


(2)向1L容密闭容器中通入1 mol CO2和nmol H2,在一定条件下发生上述反应,测得CO2的转化率a(CO2)与反应温度、投料比X[![]() ]的关系如图所示。
]的关系如图所示。
①X1_______X2(填“>”“<”或“=”,下同),平衡常数Ka____Kb____Kc。
②若B点时X=3,则平衡常数Kb=__________(代入数据列出算式即可)。
③下列措施能同时满足增大反应速率和提髙CO2转化率的是______________。
a.升高温度 b.加入催化剂 c.增大投料比X d.增加压强
e.将产物从反应体系中分离出来
(3)乙烯也可作为制备甲酸的基础工业原料,常温时,HCOOH的电离平衡常数Ka=1.8×l0-4mol·L-1,pH=12的HCOONa和含少量NaOH混合溶液中。
①书写HCOONa的水解离子反应方程式_________________。
②该溶液中离子浓度关系:  =_________mol·L-1
=_________mol·L-1
③若0. lmol/L的HCOONa溶液中加入等体积的0.09mol/LHCOOH,配制了pH=6.8的溶液,则该溶液中微粒浓度由小到大的顺序为________________。(不考虑水分子)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫是一种重要的非金属元素,广泛存在于自然界,回答下列问题:
(1)基态硫原子的价层电子排布图是___________________。
(2)①硫单质的一种结构为![]() ,杂化方式为___________,该物质__________(填“可溶”或“难溶”)于水。
,杂化方式为___________,该物质__________(填“可溶”或“难溶”)于水。
②SO42-、CS2、CO32-键角由大到小的顺序是_____________。
(3)金属镍及其化合物在合金材料以及催化剂等方面应用广泛。
①NiO、FeO的晶体结构类型均与氯化钠的相同,Ni2+和Fe2+的离子半径分别为69pm和78pm,则熔点FeO__________NiO(填“<”或“>”)
②铁有δ、Υ、ɑ三种同素异形体,各晶胞如下图,则δ、ɑ两种晶胞中铁原子的配位数之比为_________。

(4)某钙钛型复合氧化物如图1所示,以A原子为晶胞的顶点,A位可以是Ca、Sr、Ba或Pb,当B位是V、Cr、Mn、Fe等时,这种化合物具有CMR效应。

①用A、B、O 表示这类特殊晶体的化学式:____________。
②已知La为+3价,当被钙等二价元素A替代时,可形成复合钙钛化合物La1-xAxMnO3(x<0.1),此时一部分锰转变为+4价。导致材料在某一温度附近有反铁磁—铁磁、铁磁—顺磁及金属—半导体的转变,则La1-xAxMnO3中三价锰与四价锰的物质的量之比为_________。(用x表示)
③下列有关说法正确的是__________________。
A.镧、锰、氧分别位于周期表f、d、P区
B.氧的第一电离能比氮的第一电离能大
C.锰的电负性为1.59,Cr的电负性为1.66,说明锰的金属性比铬强
D.铬的堆积方式与钾相同,则其堆积方式如图2所示
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com