
【题目】假设图中原电池产生的电压、电流强度均能满足电解、电镀要求,即为理想化。①~⑧为各装置中的电极编号。下列说法错误的是( )
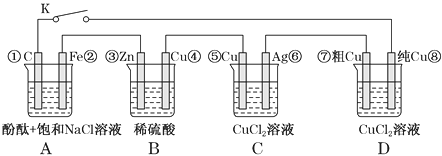
A. 当K断开时,B装置锌片溶解,有氢气产生
B. 当K闭合时,A装置发生吸氧腐蚀,在电路中作电源
C. 当K闭合后,C装置可作为电镀池装置
D. 当K闭合后,A、B装置中pH变大,C、D装置中pH不变
【答案】B
【解析】A、当K断开时,该装置不能形成闭合回路,没有电流,但B装置锌片能和稀硫酸自发反应,锌溶解,同时有H2产生,故A正确;B、当K闭合时,B能发生剧烈的氧化还原反应而作原电池,A为电解池,故B错误;C、当K闭合后,B作原电池,A、C、D作电解池,B中锌作负极,铜作正极,则A中铁作阴极、石墨作阳极,C中Cu作阳极、Ag作阴极,D中粗铜作阳极、纯铜作阴极。C装置中可以实现在Ag上镀铜,故C正确;D、当K闭合后,A中阴极上氢离子放电,阳极上氯离子放电,导致溶液氢氧根离子浓度增大,溶液的pH增大;B中正极上氢离子放电导致氢离子浓度减小,溶液的pH增大;C为电镀池,溶液的pH不变;D为电解精炼粗铜,阳极上金属失电子,阴极上铜离子得电子,所以溶液中pH不变,故D正确。故选B。


科目:高中化学 来源: 题型:
【题目】化学与环境保护、社会可持续发展密切相关,下列说法或做法合理的是( )
A. 将地沟油回收加工为生物柴油,提高资源的利用率
B. 进口国外电子垃圾,回收其中的贵重金属
C. 洗衣粉中添加三聚磷酸钠,增强去污效果
D. 大量生产超薄塑料袋,方便人们的日常生活
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据《天工开物》记载我国古代以炉甘石(主要成分是ZnCO3)来升炼倭铅(即锌),其原理如图2。已知锌的熔点420℃、沸点906℃。则下列说法不正确的是
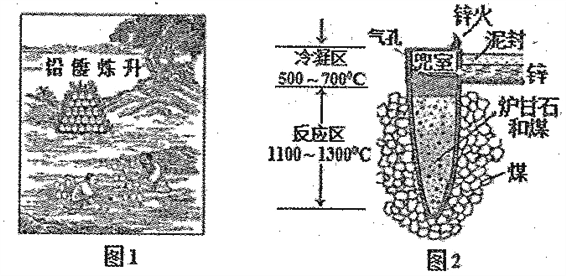
A. 升炼佞铅过程包含氧化还原反应
B. “锌火”是锌蒸气和-氧化碳在空气的燃烧
C. “泥封”的目的是为了防止得到的锌被氧化
D. 冶炼时锌变为蒸气在兜室冷凝为固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA代表阿伏加德罗常数,下列说法正确的是
A. 常温下,5.6g铁与足量的盐酸反应,失去的电子数为0.2NA
B. 标准状况下11.2L二氧化硫中含有的原于数为2NA
C. 标准状况下,22.4L氯气发生反应转移电子数一定为2NA
D. 0.1mol/LCuCl2溶液中Cl-数目是0.2NA
【答案】A
【解析】 A、因为Fe和盐酸反应氧化产物是Fe 2+ ,5.6 g铁失去电子数为0.2 N A,选项A错误;B、B. 标准状况下11.2L二氧化硫中含有的原子数为![]() 3NA=3NA,选项B错误;C、1 mol 氯气参加反应时,氯气可以只做氧化剂,也可以自身氧化还原反应,电子转移数目可以为2NA或NA,选项C错误;D、溶液体积不明确,故溶液中的氯离子的个数无法计算,选项D错误。答案选A。
3NA=3NA,选项B错误;C、1 mol 氯气参加反应时,氯气可以只做氧化剂,也可以自身氧化还原反应,电子转移数目可以为2NA或NA,选项C错误;D、溶液体积不明确,故溶液中的氯离子的个数无法计算,选项D错误。答案选A。
【题型】单选题
【结束】
23
【题目】实验室利用以下反应制取少量氨气:NaNO2+NH4Cl=NaC1+N2↑+2H2O,关于该反应的下列说法正确的是
A. NaNO2发生氧化反应
B. 每生成1molN2转移的电子的物质的量为3mol
C. NH4Cl中的氯元素被还原
D. N2既是氧化剂,又是还原剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌溴液流电池是一种新型电化学储能装置(如图所示),电解液为溴化锌水溶液,电解质溶液在电解质储罐和电池间不断循环.下列说法不正确的是( ) 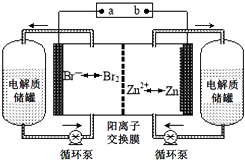
A.阳离子交换膜可阻止Br2与Zn直接发生反应
B.放电时负极的电极反应式为Zn﹣2e﹣=Zn2+
C.充电时电极a连接电源的负极
D.放电时左侧电解质储罐中的离子总浓度增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验装置不能达到实验目的的是
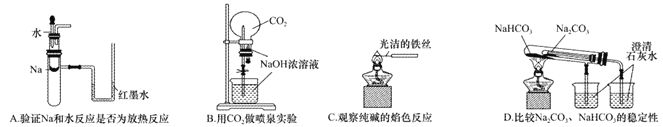
A. A B. B C. C D. D
【答案】D
【解析】A.钠与水反应放热,试管中温度升高,导致气体压强增大,红墨水出现液面差,可以达到实验目的,A正确;B.二氧化碳与氢氧化钠反应,压强减小,形成喷泉,可以达到实验目的,B正确;C.铁丝的焰色反应为无色,可用来做纯碱的焰色反应,能够达到实验目的,C正确;D.套装小试管加热温度较低,碳酸氢钠应放在套装小试管中,通过澄清水是否变浑浊可证明稳定性,题中装置无法达到实验目的,D错误;答案选D。
【题型】单选题
【结束】
18
【题目】下列反应中,反应条件、加液顺序、反应物用量或浓度等改变时,反应产物均不发生变化的是
A. 氢氧化钠与二氧化碳反应 B. 盐酸和碳酸氢钠溶液
C. 铜与硝酸反应 D. 氯化铝溶液和氢氧化钠溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外小组准备在实验室配制95mL1.0mol/L的硝酸溶液,然后再研究金属铜与硝酸的反应情况。
(1)配制95mL1.0mol/L的硝酸溶液,需要的仪器除烧杯、玻璃棒、量筒、胶头滴管外,还需要的玻璃仪器是_____________。
(2)若用10mol/L的浓硝酸来配制上述溶液,需要量取浓硝酸的体积是_________mL。
(3)配制过程中,下列操作会引起浓度偏小的是________。
A,.定容摇勾后发现液面低于刻度线,再加水至刻度线
B.定容时俯视容量瓶的刻度线
C.将溶液转入容量瓶后,没有洗涤烧杯和玻璃棒,就进行定容操作
D.容量瓶用蒸馏水洗涤后未烘干
E.量取浓硝酸后,用少量蒸馏水洗涤量筒并将洗涤液也放入烧杯
(4)课外小组同学将制得的硝酸与铜片在下列装置中反应,反应初期观察到大试管中的液体a逐渐变为蓝色,试管上方有浅红棕色气体出现。
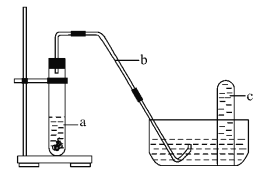
①反应初期液体a逐渐变为蓝色是由于反应生成了_________(填化学式)。
②请解释反应初期试管上方有浅红棕色气体出现的理由_________ (结合化学方程式说明)。
③导致红棕色气体在试管c中颜色消失的反应方程式为_________。
【答案】 100mL容量瓶 10.0 AC Cu(NO3)2 装置中有空气,将NO气体氧化为红棕色的NO2 气体,2NO+O2 = 2NO2 3NO2+H2O = 2HNO3+NO
【解析】(1)实验室没有95mL规格的容量瓶,必须配制100mL,配制100mL1.0molL-1的硝酸溶液步骤为:计算、称量、溶解冷却、移液、洗涤、定容、摇匀、装瓶,用到的玻璃仪器有:烧杯、玻璃棒、100ml容量瓶、胶头滴管,所以需要的玻璃仪器是:100mL容量瓶;(2)配制100mL1.0molL-1的硝酸溶液,设需要10molL-1的浓硝酸体积为V,则依据溶液稀释过程中溶质的物质的量不变得:100mL×1.0molL-1=10molL-1×V,解得V=10mL;(3)A.定容摇匀后发现液面低于刻度线,再加水至刻度线,导致溶液体积偏大,溶液浓度偏低,选项A选;B.定容时俯视容量瓶的刻度线,导致溶液体积偏小,溶液浓度偏低,选项B不选;
C.将溶液转入容量瓶后,没有洗涤烧杯和玻璃棒,就进行定容操作,导致部分溶质损耗,溶质的物质的量偏小,溶液浓度偏低,选项C选;D.容量瓶用蒸馏水洗涤后未烘干,对溶质的物质的量和溶液体积都不产生影响,溶液浓度不变,选项D不选;E.量取浓硝酸后,用少量蒸馏水洗涤量筒并将洗涤液也放入烧杯,则相当于所量硝酸偏多,导致所配溶液浓度偏大,选项E不选。答案选AC;(4)①铜与硝酸反应生成硝酸铜,化学式为Cu(NO3)2;②装置中有空气,将NO气体氧化为红棕色的NO2 气体,2NO+O2 = 2NO2,即使开始没有NO2而只有NO气体也可能变成红棕色,反应初期试管上方有浅红棕色气体出现;
③二氧化氮能够与水反应生成硝酸和一氧化氮,反应方程式:3NO2+H2O = 2HNO3+NO,所以红棕色气体在试管c中颜色消失。
点睛:本题考查了一定物质的量浓度溶液的配制及硝酸性质探究,明确配制原理及操作步骤,熟悉硝酸的性质是解题关键,易错点为(4)①铜与硝酸反应生成硝酸铜,硝酸铜为蓝色溶液;②依据一氧化氮能够与空气中氧气反应生成二氧化氮解答;③依据二氧化氮能够与水反应生成硝酸和一氧化氮解答。
【题型】综合题
【结束】
29
【题目】某废水中含有CN-和Cr2O72-等离子,需经污水处理达标后小能排放,污水处理拟采用下列流程进行处理:
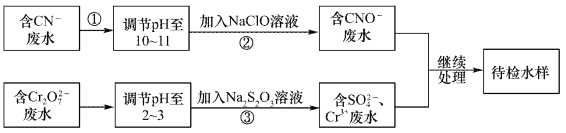
回答下列问题:
(1)步骤②中,CN-被ClO-氧化为CNO-的离子方程式为____________。
(2)步骤③的反应的离了方程式为S2O32-+Cr2O72-+H+→SO42-+Cr3++H2O(未配平),每消耗0.4mol Cr2O72-时,反应中S2O32-失去_________mol电子。
(3)含Cr3+废水可以加入熟石灰进一步处理,目的是___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表示物质结构的化学用语或模型正确的是( )
A.苯分子的比例模型: 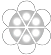
B.CO2的电子式: ![]()
C.Cl﹣离子的结构示意图: 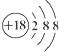
D.乙烯的结构式:CH2=CH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知浓硝酸见光或受热条件下能分解产生二氧化氮、氧气和水,下述三个实验中均有红棕色气体产生,对比分析所得结论不正确的是
|
|
|
① | ② | ③ |
A. 由①中的红棕色气体,推断产生的气体一定是混合气体
B. 红棕色气体不能表明②中木炭与浓硝酸发生了反应
C. 由③说明浓硝酸具有挥发性,生成的红棕色气体为还原产物
D. ③的气体产物中检测出CO2,由此说明木炭一定与浓硝酸发生了反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com