
【题目】向 100mL1.5mol/L 的 NaOH 溶液中缓慢通入一定量的 CO2 ,充分反应后,向所得溶液中逐滴缓慢滴加稀盐酸,所得气体的体积与所加盐酸的体积(不考虑气体溶解于水)关系如图所示。
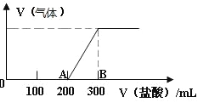
(1)通入一定量的 CO2 充分反应后的溶液中溶质为______(写化学式)
(2)AB 段所发生的离子方程式:______。
(3)滴加稀盐酸的物质的量浓度为______mol/L。
(4)通入二氧化碳的体积为____L(在标准状况下)。
【答案】NaOH 和 Na2CO3 HCO3- + H+ ==== CO2↑ + H2O 0.5 1.12
【解析】
加入盐酸200mL时开始生成气体,当加入盐酸300mL时不再产生气体,A→B段发生的反应为NaHCO3+HCl=NaCl+CO2↑+H2O,而O→A段消耗的盐酸是A→B段消耗盐酸的二倍,应为NaOH和Na2CO3的混合物,两者都可以与盐酸发生反应:NaOH+HCl=NaC+H2O、NaHCO3+HCl=NaCl+CO2↑+H2O,根据AB段消耗盐酸的体积,结合方程式计算生成二氧化碳的体积,据此答题。
(1)加入盐酸200mL时开始生成气体,当加入盐酸300mL时不再产生气体,A→B段发生的反应为NaHCO3+HCl=NaCl+CO2↑+H2O,而O→A段消耗的盐酸是A→B段消耗盐酸的二倍,应为NaOH和Na2CO3的混合物,故答案为:NaOH和Na2CO3。
(2)A→B段发生的反应为NaHCO3+HCl=NaCl+CO2↑+H2O,离子方程式为:HCO3-+H+=CO2↑+H2O,故答案为:HCO3-+H+=CO2↑+H2O。
(3)B点溶液中的溶质为NaCl,由氯离子守恒可以得知:n(HCl)=n(NaCl)=n(NaOH)=1.5mol/L×0.1L=0.15mol,c(HCl)=n/V=0.15mol/0.3L=0.5mol/L,故答案为:0.5。
(4)AB段消耗盐酸为:0.5mol/L×0.1L=0.05mol,由NaHCO3+HCl=NaCl+CO2↑+H2O可知,生成二氧化碳的物质的量为0.05mol,标况下生成二氧化碳的体积为0.05mol×22.4L/mol=1.12L,根据碳元素守恒,则通入二氧化碳的体积在标准状况下也为1.12L,故答案为:1.12。


科目:高中化学 来源: 题型:
【题目】下列关于硫酸的叙述中,正确的是( )
A.浓硫酸具有吸水性,能使蔗糖炭化
B.浓硫酸有强氧化性,常温下可贮存在铝、铁容器中
C.浓硫酸具有脱水性,能够干燥氨气、氯气等气体
D.稀释浓硫酸时,应将水沿着器壁慢慢加入到浓硫酸中,并用玻璃棒不断搅拌
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向某密闭容器中加入0.3molA、0.1molC和一定量的B三种气体.一定条件下发生反应,各物质浓度随时间变化如甲图所示(t0~t1阶段的c(B)变化未画出).乙图为t时刻后改变条件平衡体系中正、逆反应速率随时间变化的情况,且四个阶段都各改变一种反应条件(浓度、温度、压强、催化剂)且互不相同,t3~t4阶段为使用催化剂.下列说法中不正确的是

A. 若t1=15s,则用C的浓度变化表示的t0~t1段的平均反应速率为0.004molL-1s-1
B. t4~t5阶段改变的条件一定为减小压强
C. 该容器的容积为2L,B的起始物质的量为0.02mol
D. 该化学反应方程式为3A(g)B(g)+2C(g)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】营养专家认为菠菜中铁的含量较高,缺铁性贫血患者多食用菠菜,对疾病的治疗有一定的疗效。你认为菠菜所影响的缺铁性贫血患者合成的化合物名称,及最终决定菠菜含铁量较高的化合物分别是( )
A. 血浆蛋白、核酸 B. 血红蛋白、核酸 C. 血浆蛋白、载体 D. 血红蛋白、载体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求写出下列反应的方程式:
(1)实验室制备氯气的离子反应方程式_______________;
(2)乙醇催化氧化反应(铜做催化剂)_______________;
(3)苯与浓硝酸反应_______________;
(4)CH3CH=CH2生成高聚物_______________;
(5)往氢氧化钙溶液中加入过量碳酸氢钠的离子方程式_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I:已知:反应aA(g)+bB(g) ![]() cC(g),某温度下,在 2 L 的密闭容器中投入一定量的A、B,两种气体的物质的量浓度随时间变化的曲线如图所示。
cC(g),某温度下,在 2 L 的密闭容器中投入一定量的A、B,两种气体的物质的量浓度随时间变化的曲线如图所示。
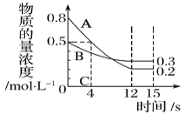
(1)经测定前4 s内v(C)=0.025 mol·L-1·s-1,则该反应的化学方程式为_______________。
(2)若上述反应分别在甲、乙、丙三个相同的密闭容器中进行,经同一段时间后,测得三个容器中的反应速率分别为甲:v(A)=0.3 0mol·L-1·s-1; 乙:v(B)=0.10 mol·L-1·s-1; 丙:v(C)=2.4mol·L-1·min-1,则甲、乙、丙三个容器中反应速率由快到慢的顺序为_______(用甲、乙、丙表示)。
Ⅱ: 某学生为了探究锌与盐酸反应过程中的速率变化,他在100 mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气(气体体积已折合成标准状况),实验记录如表(累计值):
时间/min | 1 | 2 | 3 | 4 | 5 | 6 |
氢气体积/mL | 50 | 120 | 224 | 392 | 472 | 502 |
(3)哪一时间段反应速率最大______(填0~1、1~2、2~3、3~4、4~5、5~6 min,下同),原因是_____________ 。
(4)如果反应太激烈,为了减缓反应速率而又不减少产生氢气的量,他在盐酸中分别加入等体积的下列溶液,你认为可行的是__________(填字母)
A.CH3COONa B.NaNO3溶液 C.KCl溶液 D.Na2CO3溶液
Ⅲ:(5)下列说法可以证明H2(g)+I2(g) ![]() 2HI(g)已达平衡状态的是________。
2HI(g)已达平衡状态的是________。
A.单位时间内生成n mol H2的同时,生成n mol HI
B.一个H—H键断裂的同时有两个H—I键断裂
C.温度和体积一定时,混合气体颜色不再变化
D.反应速率v(H2)=v(I2)=![]() v(HI)
v(HI)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上常利用反应Cr2O7n-+CH3OH+H+→Cr3++CO2↑+H2O(未配平)来测定工业甲醇中甲醇的含量,下列说法中正确的是( )
A. 溶液的颜色从灰绿色变为橙色
B. Cr2O7n-发生氧化反应
C. 若配平后Cr3+和CO2的化学计量数比为2:1,则Cr2O7n-中的n=2
D. 若有3.2 g CH3OH参加反应,则转移的电子数为6.02×1022
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com