
��һ�������£���3 mol A��1 mol B�����������ڹ̶��ݻ�Ϊ2 L���ܱ������У��������·�Ӧ��3A(g)��B(g)  xC(g)��2D(g)�� 2 min��÷�Ӧ�ﵽƽ�⣬����0.8 mol D�������C��Ũ��Ϊ0.2 mol��L��1���������ж���ȷ����
xC(g)��2D(g)�� 2 min��÷�Ӧ�ﵽƽ�⣬����0.8 mol D�������C��Ũ��Ϊ0.2 mol��L��1���������ж���ȷ����
| A��x��2 |
| B��2 min��A�ķ�Ӧ����Ϊ0.6 mol��L��1��min��1 |
| C��B��ת����Ϊ40% |
| D�������������ܶȲ��䣬������÷�Ӧ�ﵽƽ��״̬ |
 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
�����ͬ�ļס������������У� �ֱ��е����ʵ�����A2��B2������ͬ�¶��·�����Ӧ��2A2��g��+ B2��g��=2C��g�����ﵽƽ�⣬��Ӧ�����У�����������������䣬����������ѹǿ���䣬����������A2��ת����ΪP��������������A2��ת����Ϊ
| A������P�� | B������P�� | C��С��P�� | D�����ж� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
���淴ӦmA���̣���nB������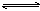 eC��������fD����������Ӧ�����У���������������ʱ��C�İٷֺ�����C�������¶ȣ�T����ѹǿ��P���Ĺ�ϵ����ͼ������������ȷ����( )
eC��������fD����������Ӧ�����У���������������ʱ��C�İٷֺ�����C�������¶ȣ�T����ѹǿ��P���Ĺ�ϵ����ͼ������������ȷ����( )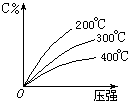
| A����ƽ����������C������ |
| B����ѧ����ʽ��n��e+f |
| C����ƽ��������£�ƽ������ |
| D����ƽ�������A����������ƽ�������ƶ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
һ���¶��·�ӦN2��O2 2NO���ܱ������н��У����д�ʩ���ı仯ѧ��Ӧ���ʵ���
2NO���ܱ������н��У����д�ʩ���ı仯ѧ��Ӧ���ʵ���
| A����С���ʹѹǿ���� | B�����ݣ�����N2 |
| C�����ݣ�����He | D����ѹ������He |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
�����¶ȣ��������ݲ�һ���������
| A����ѧ��Ӧ���� | B��ˮ�����ӻ�����Kw |
| C����ѧƽ�ⳣ�� | D������ĵ���ƽ�ⳣ��Ka |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
������ʵ��������������ԭ�����͵���
A����ˮ��������ƽ��Br2+H2O HBr+HBrO����������������Һ����Һ��ɫ��dz HBr+HBrO����������������Һ����Һ��ɫ��dz |
| B���ϳɰ���Ӧ��Ϊ��߰��IJ��ʣ�������Ӧ��ȡ�����¶ȵĴ�ʩ |
C����ӦCO(g)+NO2(g) CO2(g)+NO(g)(����ӦΪ���ȷ�Ӧ)����ƽ��������¶���ϵ��ɫ���� CO2(g)+NO(g)(����ӦΪ���ȷ�Ӧ)����ƽ��������¶���ϵ��ɫ���� |
D������2HI(g) H2(g)+I2(g)����ƽ�����С���������ʹ��ϵ��ɫ���� H2(g)+I2(g)����ƽ�����С���������ʹ��ϵ��ɫ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
100 mLŨ��Ϊ2 mol��L��1�������������пƬ��Ӧ��Ϊ�ӿ췴Ӧ���ʣ��ֲ�Ӱ�������������������ɲ��õķ�����
| A������������6 mol��L��1������ | B�����������Ȼ�ͭ��Һ |
| C��������������ˮ | D�������������Ȼ�����Һ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
���淴Ӧ2SO2(g) ��O2(g) 2SO3(g)�ڲ�ͬ�����µķ�Ӧ�������£����з�Ӧ���������� ( )
2SO3(g)�ڲ�ͬ�����µķ�Ӧ�������£����з�Ӧ���������� ( )
| A����(SO2)=0.5mol/(L?s) | B����(O2)=1mol/(L?min) |
| C����(SO3)=0.6mol/(L?s) | D����(O2)=0.4mol/(L?s) |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
���ܱ������з������з�Ӧ��aA(g) cC(g)+dD(g)���ﵽƽ����������ѹ����ԭ����һ�룬���ٴδﵽ��ƽ��ʱ��D��Ũ��Ϊԭ����1��8��������˵����ȷ����
cC(g)+dD(g)���ﵽƽ����������ѹ����ԭ����һ�룬���ٴδﵽ��ƽ��ʱ��D��Ũ��Ϊԭ����1��8��������˵����ȷ����
��ƽ��������Ӧ�����ƶ��� ��ƽ�����淴Ӧ�����ƶ���
��A��ת�������� �����������ʶ�����
| A���ڢ� | B���٢� | C���ۢ� | D���٢� |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com