
【题目】控制适当的条件,将反应2Fe3++2I-![]() 2Fe2++I2设计成如图所示的原电池。下列判断正确的是 ( )
2Fe2++I2设计成如图所示的原电池。下列判断正确的是 ( )

A.反应开始时,乙中电极反应为2I-+2e-= I2
B.反应开始时,甲中石墨电极上发生氧化反应
C.电流表指针为零时,两池溶液颜色不相同
D.平衡时甲中溶入FeCl2固体后,乙池的石墨电极为正极
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A. 炼铁需要用到石灰石 B. 钠钾合金可用作核反应堆热交换剂
C. 工业上可用铁质容器存放浓硫酸 D. 用超纯硅制造光导纤维
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应mA(固)+nB(气)cC(气)+fD(气)反应过程中,当其它条件不变时,C的体积分数(C%)与温度(T)和压强(P)的关系如下图所示,下列叙述正确的是( )
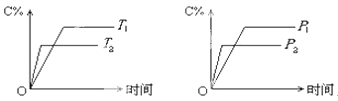
A.化学方程式中n>c+f
B.达到平衡后,若使温度升高 ,化学平衡向逆反应方向移动
C.达到平衡后,若使用催化剂,C的体积分数增大
D.达到化学平衡后,增加A的量有利于化学平衡向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ、某实验小组同学对电化学原理进行了一系列探究活动。
(1)如图1为某实验小组设计的原电池装置,反应前,电极质量相等,一段时间后,两电极质量相差12 g,导线中通过________mol电子。
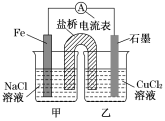
(2)如图,其他条件不变,若将乙烧杯中的CuCl2溶液换为NH4Cl溶液,则石墨电极的电极反应方程式为_____________________
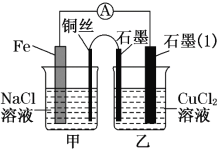
(3)如图,其他条件不变,若将盐桥换成弯铜导线与石墨相连成n型,如下图所示乙装置中与铜丝相连的石墨电极上发生的反应方程式为_____________________
Ⅱ、氢能是发展中的新能源,它的利用包括氢的制备、储存和应用三个环节。回答下列问题:
(1)与汽油等燃料相比,氢气作为燃料的两个明显的优点是________________(写两点)
(2)化工生产的副产品也是氢气的来源。电解法制取有广泛用途的Na2FeO4,同时获得氢气。总反应方程式为:Fe+2H2O+2OH![]() FeO42+3H2↑,工作原理如下图1所示。装置通电后,铁电极附近生成紫红色的FeO42,镍电极有气泡产生。若氢氧化钠溶液浓度过高,铁电极区会产生红褐色物质。已知:Na2FeO4只在强碱性条件下稳定,易被H2还原。
FeO42+3H2↑,工作原理如下图1所示。装置通电后,铁电极附近生成紫红色的FeO42,镍电极有气泡产生。若氢氧化钠溶液浓度过高,铁电极区会产生红褐色物质。已知:Na2FeO4只在强碱性条件下稳定,易被H2还原。
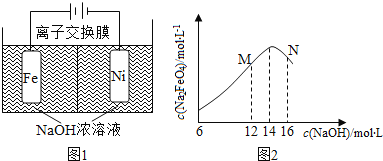
①电解一段时间后,c(OH)降低的区域在________________(填“阴极室”或“阳极室”)
②电解过程中,须将阴极产生的气体及时排出,其原因是______________________
③c( Na2FeO4)随初始c(NaOH)的变化如图2,任选M、N两点中的一点,分析c(Na2FeO4)低于最高值的原因:_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 所有的放热反应都能在常温常压下自发进行
B. Ba(OH)2·8H2O与NH4Cl反应属放热反应
C. 天然气燃烧时,其化学能全部转化为热能
D. 反应热只与反应体系的始态和终态有关,而与反应的途径无关
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com