
| A. | 0.2 mol | B. | 0.4 mol | C. | 0.8 mol | D. | 0.9 mol |
分析 整个反应过程中,Cu失去电子数等于NO3-生成NO2-得到的电子数,根据转移电子守恒计算n(NaNO2),再根据Na原子守恒计算n(NaNO3).
解答 解:n(Cu)=$\frac{51.2g}{64g/mol}$=0.8mol,n(NaOH)=2mol/L×0.5L=1mol,整个反应过程中,Cu失去电子数等于NO3-生成NO2-得到的电子数,根据转移电子守恒得n(NaNO2)=$\frac{0.8mol×2}{5-3}$=0.8mol,根据Na原子守恒得n(NaNO3)=n(NaOH)-n(NaNO2)=1mol-0.8mol=0.2mol,
故选A.
点评 本题考查氧化还原反应有关计算,为高频考点,明确反应过程中转移电子关系是解本题关键,侧重考查学生分析判断计算能力,注意转移电子守恒、原子守恒的灵活运用,很多同学往往思考生成氮氧化物和氮氧化物转化为钠盐时转移电子而无法解答,题目难度中等.


 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案 A加金题 系列答案
A加金题 系列答案科目:高中化学 来源: 题型:解答题
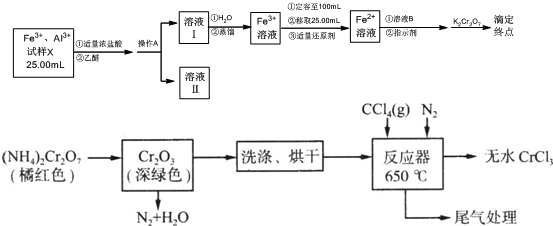
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
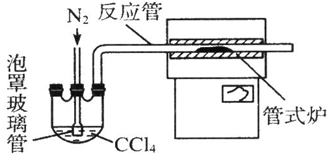
 某学生想利用如图装置(烧瓶位置不能移动)收集下列气体:①H2; ②Cl2;③SO2;④HCl;⑤NH3;⑥NO;⑦NO2.下列说法正确的是( )
某学生想利用如图装置(烧瓶位置不能移动)收集下列气体:①H2; ②Cl2;③SO2;④HCl;⑤NH3;⑥NO;⑦NO2.下列说法正确的是( )| A. | 烧瓶是干燥的,由B进气,可收集②③④⑥⑦ | |
| B. | 烧瓶是干燥的,由A进气,可收集①⑤ | |
| C. | 在烧瓶中充满水,由A进气,可收集①⑤⑦ | |
| D. | 在烧瓶中充满水,由B进气,可收集⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 臭氧是一种强氧化剂可与碘化钾水溶液发生反应生成氧气和单质碘.向反应后的溶液中滴入酚酞,溶液变为红色.
臭氧是一种强氧化剂可与碘化钾水溶液发生反应生成氧气和单质碘.向反应后的溶液中滴入酚酞,溶液变为红色.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
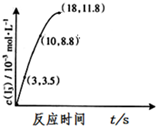
 已知:有机氯化剂磺酰氯SO2Cl2的制法:SO2(g)+Cl2(g)?SO2Cl2(g)△H<0
已知:有机氯化剂磺酰氯SO2Cl2的制法:SO2(g)+Cl2(g)?SO2Cl2(g)△H<0| c(SO2)/mol•L-1 | c(Cl2)/mol•L-1 | v/mol•L-1•S-1 |
| 1.0 | 1.0 | 1.0k |
| 2.0 | 1.0 | 2.0k |
| 2.0 | 4.0 | 8.0k |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
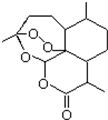 2015年诺贝尔奖获得者屠呦呦提取的抗疟新药青蒿素的结构简式,用键线式表示如图.
2015年诺贝尔奖获得者屠呦呦提取的抗疟新药青蒿素的结构简式,用键线式表示如图. ,需要在有机合成中引入羟基,引入羟基的反应类型有①②⑤.(选填编号)
,需要在有机合成中引入羟基,引入羟基的反应类型有①②⑤.(选填编号)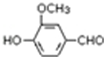 )可用于合成青蒿素,合成天然香草醛的反应如下:
)可用于合成青蒿素,合成天然香草醛的反应如下:
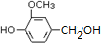 .
.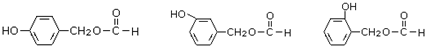 (其中之一).
(其中之一).查看答案和解析>>
科目:高中化学 来源: 题型:推断题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液是电中性的,胶体是带电的 | |
| B. | 直径介于1nm-100nm之间的微粒称为胶体 | |
| C. | 一束光线分别通过溶液和胶体时,后者会出现明显的光带,前者则没有 | |
| D. | 溶液中溶质分子的运动有规律,胶体中分散质粒子的运动无规律,即布朗运动 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
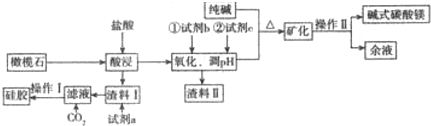
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com