
| A. | 冰晶石能降低Al2O3的熔点,用Al2O3炼铝时加入它可减少能耗 | |
| B. | Mg在空气中燃烧时发出耀眼的白光,可用于制造信号弹 | |
| C. | 氧化钠能与H2O、CO2反应,可用作漂白剂和供氧剂 | |
| D. | 常温时浓硝酸与铁不反应,可用铁桶贮存浓硝酸 |
分析 A.氧化铝熔点很高,为降低其熔点,常常加入冰晶石;
B.镁燃烧发出耀眼的白光;
C.氧化钠不能用作漂白剂和供氧剂;
D.浓硝酸与铁发生钝化反应.
解答 解:A.工业上采用电解熔融氧化铝的方法冶炼铝,在实际生产中,向氧化铝中添加冰晶石是为了降低氧化铝的熔点,故A正确;
B.镁燃烧发出耀眼的白光,可用作信号弹,故B正确;
C.氧化钠不具有强氧化性,与水、二氧化碳反应不生成氧气,不能用作漂白剂和供氧剂,故C错误;
D.浓硝酸与铁发生钝化反应,故D错误.
故选AB.
点评 本题考查综合考查元素化合物知识,为高频考点,明确反应原理是解本题关键,熟悉常见物质的性质,注意D中反应原理,会运用化学知识解释生活现象,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
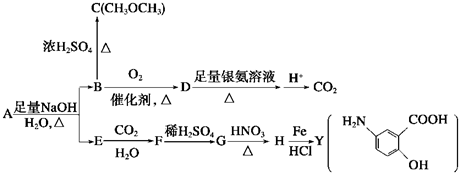
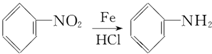
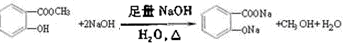 .
. 和
和 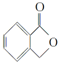 ,鉴别I和J的试剂为FeCl3或浓溴水.
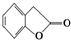
,鉴别I和J的试剂为FeCl3或浓溴水.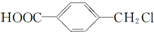 制得,写出K在浓硫酸作用下生成的聚合物的结构简式:
制得,写出K在浓硫酸作用下生成的聚合物的结构简式: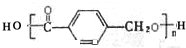 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质子数是212 | B. | 中子数是130 | C. | 电子数是194 | D. | 质量数是82 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2O2的电子: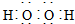 | |
| B. | 乙烯的结构简式:CH2CH2 | |
| C. | S2-离子的结构示意图: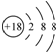 | |
| D. | FeSO4的电离方程式:FeSO4═Fe3++SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
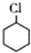 (一氯环己烷)$→_{II}^{NaOH,乙醇,△}$
(一氯环己烷)$→_{II}^{NaOH,乙醇,△}$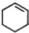 $→_{Ⅲ}^{Br_{2}的CCl_{4}溶液}$B$\stackrel{Ⅳ}{→}$
$→_{Ⅲ}^{Br_{2}的CCl_{4}溶液}$B$\stackrel{Ⅳ}{→}$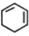

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com