
【题目】根据硅和二氧化硅的性质,回答下列问题:
(1)月球上某矿石经处理得到的MgO中含有少量SiO2,除去SiO2的离子方程式为___。
(2)由粗硅制纯硅过程如下:Si(粗)![]() SiCl4
SiCl4![]() SiCl4(纯)
SiCl4(纯)![]() Si(纯),请写出上述过程中有关反应的化学方程式:___,___。
Si(纯),请写出上述过程中有关反应的化学方程式:___,___。
【答案】SiO2+2OH-=SiO32-+H2O Si+2Cl2![]() SiCl4 SiCl4+2H2
SiCl4 SiCl4+2H2![]() Si+4HCl
Si+4HCl
【解析】
(1)MgO与强碱不反应,二氧化硅与强碱反应,根据二者性质的差别分析;
(2)粗硅与Cl2反应为生成四氯化硅,四氯化硅被氢气还原生成纯硅;
(1) 因为SiO2能够和NaOH溶液反应生成可溶性的硅酸钠,MgO不能和NaOH溶液反应且难溶于水,所以可以加入NaOH溶液,然后过滤除去SiO2,反应的离子方程式为SiO2+2OH-=SiO32-+H2O;
故答案为:SiO2+2OH-=SiO32-+H2O;
(2)粗硅与Cl2反应为Si+2Cl2![]() SiCl4,SiCl4与氢气反应为SiCl4+2H2
SiCl4,SiCl4与氢气反应为SiCl4+2H2![]() Si+4HCl;
Si+4HCl;
故答案为:Si+2Cl2![]() SiCl4;SiCl4+2H2
SiCl4;SiCl4+2H2![]() Si+4HCl。
Si+4HCl。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】在25 ℃、101 kPa时,反应能量转化关系如图所示,下列说法不正确的是

已知:C(s)+O2(g)===CO2(g) ΔH1;CO(g)+![]() O2(g)===CO2(g) ΔH2;
O2(g)===CO2(g) ΔH2;
A. ΔH2=-282.9kJ·mol-1
B. 2C(s)+O2(g)===2CO(g) ΔH=-221.2 kJ·mol-1
C. ΔH1>ΔH2
D. CO2(g)分解为C(s)和O2(g)是吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaOH溶液滴定邻苯二甲酸氢钾(邻苯二甲酸H2A的Ka1=1.1×103 ,Ka2=3.9×106)溶液,混合溶液的相对导电能力变化曲线如图所示,其中b点为反应终点。下列叙述错误的是( )

A.混合溶液的导电能力与离子浓度和种类有关
B.b点的混合溶液pH=7
C.Na+与A2的导电能力之和大于HA的
D.c点的混合溶液中,c(Na+)>c(K+)>c(OH)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁是应用最广泛的金属,自远古时代人类就学会了炼铁,到目前为止,人类研制出了很多炼铁的方法。某研究性学习小组同学在实验室中模拟工业炼铁的过程,实验装置如下:
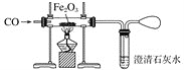
(1)写出得到单质铁的化学方程式:_________________________。
(2)实验过程中看到玻璃管内的粉末由红棕色逐渐变黑,请设计一个实验来验证生成了单质铁:______。
(3)装置末端气球的作用为_____________________________。实验结束时,应该先停止加热还是先停止通入CO?原因是什么?_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2 L密闭容器内,t℃时发生反应:N2(g)+3H2(g)![]() 2NH3(g),在体系中,n(N2)随时间的变化如下表:
2NH3(g),在体系中,n(N2)随时间的变化如下表:
时间(min) | 0 | 1 | 2 | 3 | 4 | 5 |
N2的物质的量(mol) | 0.20 | 0.10 | 0.08 | 0.06 | 0.06 | 0.06 |
(1)上述反应在第5min时,N2的转化率为_______________________;
(2)用H2表示从0~2 min内该反应的平均速率v(H2)=_____________;
(3)t℃时,在4个均为2L密闭容器中不同投料下进行合成氨反应。根据在相同时间内测定的结果,判断该反应进行快慢的顺序为______________。(用字母填空,下同);
a.v(NH3)=0.05 mol·L-1·min-1 b.v(H2)=0.03 mol·L-1·min-1
c.v(N2)=0.02 mol·L-1·min-1 d.v(H2)=0.00 l mol·L-1·s-1
(4)下列表述能作为反应达到化学平衡状态的标志是_____________。
a.反应速率v(N2):v(H2):v(NH3)=1:3:2
b.各组分的物质的量浓度不再改变
c.混合气体的平均相对分子质量不再改变
d.混合气体的密度不变
e.单位时间内生成n mol N2的同时,生成3n mol H2
f.v(N2)消耗=2v(NH3)消耗
g.单位时间内3mol H—H键断裂的同时2mol N—H键也断裂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】光刻技术需利用深紫外激光,我国是唯一掌握通过非线性光学晶体变频来获得深紫外激光技术的国家。目前唯一实用化的晶体是氟硼铍酸钾(KBeBF,含K、B、Be、O、F元素)。
回答下列问题:
(1)一群均处于激发态1s22s13s1的铍原子,若都回到基态,最多可发出___种波长不同的光。
A.1 B.2 C.3 D.4
(2)Be和B都容易与配体形成配位键,如[BeF4]-、[B(OH)4]-等,从原子结构分析其原因是__。
(3)氟硼酸钾是制备KBeBF的原料之一,高温下分解为KF和BF3。KF的沸点比BF3的高,原因是___。
(4)BF3易水解得到H3BO3(硼酸)和氢氟酸。氢氟酸浓溶液中因F-与HF结合形成HF![]() 使酸性大大增强。HF
使酸性大大增强。HF![]() 的结构式为___;H3BO3和BF
的结构式为___;H3BO3和BF![]() 中,B原子的杂化类型分别为___、__。
中,B原子的杂化类型分别为___、__。
(5)KBeBF晶体为层片状结构,图1为其中一层的局部示意图。平面六元环以B—O键和Be—O键交织相连,形成平面网状结构,每个Be都连接一个F,且F分别指向平面的上方或下方,K+分布在层间。KBeBF晶体的化学式为____。

(6)BeO晶体也是制备KBeBF的原料,图2为其晶胞结构示意图。
①沿着晶胞体对角线方向的投影,下列图中能正确描述投影结果的是___。

②BeO晶胞中,O的堆积方式为____;设O与Be的最近距离为acm,NA表示阿伏加德罗常数的值,则BeO晶体的密度为____g·cm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机化合物M的分子式为C9H12,其中可能含有苯环的结构有![]() 、
、 、
、 等,下列说法错误的是
等,下列说法错误的是
A.有机物M不管是否含有苯环,在一定条件下都能发生氧化反应
B.有机物M的一种结构为![]() 该有机物不能与溴单质发生加成反应
该有机物不能与溴单质发生加成反应
C.除了上述三种物质,M的含苯环的同分异构体还有5种(不考虑立体异构)
D.![]() 与苯互为同系物
与苯互为同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知2NO2(g) ![]() N2O4(g),在体积相同的A和B两个带活塞的玻璃容器中,如分别注入1/4容积颜色相同的NO2和Br2(气),然后将活塞同时向外拉到1/2处(快速),过一会儿可以看到
N2O4(g),在体积相同的A和B两个带活塞的玻璃容器中,如分别注入1/4容积颜色相同的NO2和Br2(气),然后将活塞同时向外拉到1/2处(快速),过一会儿可以看到
A.A中颜色比B中浅B.A中颜色比B中深
C.A、B中颜色深浅一样D.A、B中颜色都比开始时深
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面有关叙述中,不正确的是( )
A.CH4中心原子的杂化轨道类型为sp3杂化
B.以非极性键结合起来的双原子分子一定是非极性分子
C.氯化钠晶体中,Na+和Cl-的配位数均为8
D.镍元素基态原子的电子排布式为:1s22s22p63s23p63d84s2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com