
【题目】在25 ℃时,用石墨电极电解2.0 L 2.5 mol·L -1 CuSO4溶液,如有0.2 mol电子发生转移,请回答下列问题:
(1)阳极发生__________反应,电极反应式为________________________________________________。
(2)电解后得到的铜的质量是__________,得到氧气的体积是__________(标准状况),溶液的pH是__________。
(3)如用等质量的两块铜片代替石墨作电极,电解后两铜片的质量相差__________________。
【答案】 氧化 4OH--4e-===2H2O+O2↑ 6.4 g 1.12 L 1 12.8 g
【解析】在25℃时,用石墨电极电解2.0 L,2.5mol/LCuSO4溶液中Cu2+物质的量为5mol。
(1)电解过程中,溶液中阴离子OH-、SO42-移向阳极,氢氧根离子放电发生氧化反应,电极反应式:4OH--4e-═2H2O+O2↑,故答案为:氧化;4OH--4e-═2H2O+O2↑;
(2)依据电极反应电子守恒,有0.20mol电子发生转移,生成铜物质的量为0.1mol,生成氧气物质的量为0.05mol,
阳极反应为:4OH- - 4e- ═ 2H2O + O2↑
0.2mol 0.2mol 0.05mol
阴极反应为:2Cu2+ + 4e- ═ 2Cu
0.1mol 0.2mol 0.1mol
所以电解过程中得到铜的质量0.1mol×64g/mol=6.4g;生成氧气的体积=0.05mol×22.4L/mol=1.12L;溶液的PH的计算可以依据水电离出的氢离子和氢氧根离子守恒,减少氢氧根离子0.2mol,溶液中增加氢离子0.2mol,c(H+)=![]() =0.1mol/L,pH=-lgc(H+)=1,故答案为:6.4g;1.12L;1;
=0.1mol/L,pH=-lgc(H+)=1,故答案为:6.4g;1.12L;1;
(3)如用等质量的两块铜片代替石墨作电极,是镀铜,阳极反应为:Cu-2e-=Cu2+;阴极电极反应为:Cu2++2e-=Cu;电子转移0.2mol,阳极减少质量为0.1mol×64g/mol=6.4g;同时阴极析出铜6.4g,电解后两铜片的质量相差12.8g,故答案为:12.8g。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】已知钡的活动性介于钠和钾之间,下列叙述正确的是( )
A. 钡与水反应不如钠与水反应剧烈
B. 钡可以从KCl溶液中置换出钾
C. 氧化性:K+>Ba2+>Na+
D. 碱性:KOH>Ba(OH)2>NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】东晋葛供《肘后备急方》中“青蒿一握,以水升渍,绞取汁,尽服之”。下列操作与“渍”和“绞”原理相近的是( )
A. 浸泡 过滤 B. 煮沸 研碎 C. 萃取 剪断 D. 蒸馏 捣碎
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)有一种新型的高能电池—钠硫电池(熔融的钠、硫为两极,以Na+导电的βAl2O3陶瓷作固体电解质),反应式为2Na+xS![]() Na2Sx。
Na2Sx。

①充电时,钠极与外电源________(填“正”或“负”)极相连。其阳极反应式:_______________________________________。
②放电时,发生还原反应的是__________(填“钠”或“硫”)极。
③用该电池作电源电解(如上图)NaCl溶液(足量),写出电解NaCl溶液的离子方程式:________________________________,若钠硫电池工作一段时间后消耗23 g Na (电能的损耗忽略不计),若要使溶液完全恢复到起始浓度(温度不变,忽略溶液体积的变化),可向溶液中加入(或通入)________(填物质名称),其质量约为_____________________________________。
④若用该钠硫电池作电源在一铁片上镀铜,此铁片与__________(填“钠”或“硫”)极相连。
(2)某原电池装置如下图所示,电池总反应为2Ag+Cl2===2AgCl。

①放电时,交换膜左侧溶液中实验现象____________________。
②当电路中转移0.01 mol e-时,交换膜左侧溶液中约减少__________ mol离子。
③该电池的能量转化的主要形式为_________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分子的性质是由分子的结构决定的,通过对下列分子结构的观察来推测它的性质:
![]()
(1)苯基部分可发生____反应和____反应。
(2)—CH![]() CH2部分可发生____反应和___反应。
CH2部分可发生____反应和___反应。
(3)写出此有机物形成的高分子化合物的结构简式:_______。
(4)试判断此有机物的—C(CH2Cl)3部分_______(填“能”或“不能”)发生消去反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【2014新课标2】37.[化学选修——3:物质结构与性质]
周期表前四周期的元素a、b、c、d、e,原子序数依次增大。a的核外电子总数与其周期数相同,b的价电子层中的未成对电子有3个,c的最外层电子数为其内层电子数的3倍,d与c同族;e的最外层只有1个电子,但次外层有18个电子。回答下列问题:
(1)b、c、d中第一电离能最大的是 (填元素符号),e的价层电子轨道示意图为 。
(2)a和其他元素形成的二元共价化合物中,分子呈三角锥形,该分子的中心原子的杂化方式为 ;分子中既含有极性共价键,又含有非极性共价键的化合物是 (填化学式,写两种)。
(3)这些元素形成的含氧酸中,分子的中心原子的价层电子对数为3的酸是 ;酸根呈三角锥结构的酸是 。(填化学式)
(4)e和c形成的一种离子化合物的晶体结构如图1,则e离子的电荷为 。
(5)这5种元素形成的一种1:1型离子化合物中,阴离子呈四面体结构;阳离子呈轴向狭长的八面体结构(如图2所示)。该化合物中阴离子为 ,阳离子中存在的化学键类型有 ;该化合物加热时首先失去的组分是 ,判断理由是 。
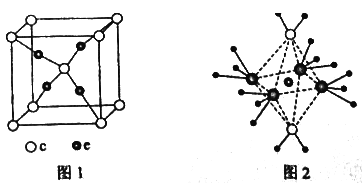
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【2015山东卷】毒重石的主要成分BaCO3(含Ca2+、Mg2+、Fe3+等杂质),实验室利用毒重石制备BaCl2·2H2O的流程如下:

(1)毒重石用盐酸浸取前需充分研磨,目的是 。实验室用37%的盐酸配置15%的盐酸,除量筒外还需使用下列仪器中的 。
a.烧杯 b.容量瓶 c.玻璃棒 d.滴定管
(2)
Ca2+ | Mg2+ | Fe3+ | |
开始沉淀时的pH | 11.9 | 9.1 | 1.9 |
完全沉淀时的pH | 13.9 | 11.1 | 3.2 |
加入NH3·H2O调节pH=8可除去 (填离子符号),滤渣Ⅱ中含 (填化学式)。加入H2C2O4时应避免过量,原因是 。
已知:Ksp(BaC2O4)=1.6×10-7,Ksp(CaC2O4)=2.3×10-9
(3)利用简洁酸碱滴定法可测定Ba2+的含量,实验分两步进行。
已知:2CrO42—+2H+=Cr2O72—+H20 Ba2++CrO42—=BaCrO4↓
步骤Ⅰ 移取xml一定浓度的Na2CrO4溶液与锥形瓶中,加入酸碱指示剂,用b mol·L-1盐酸标准液滴定至终点,测得滴加盐酸体积为V0mL。
步骤Ⅱ:移取y mLBaCl2溶液于锥形瓶中,加入x mL与步骤Ⅰ 相同浓度的Na2CrO4溶液,待Ba2+完全沉淀后,再加入酸碱指示剂,用b mol·L-1盐酸标准液滴定至终点,测得滴加盐酸的体积为V1mL。
滴加盐酸标准液时应用酸式滴定管,“0”刻度位于滴定管的 (填“上方”或“下方”)。BaCl2溶液的浓度为 mol·L-1,若步骤Ⅱ中滴加盐酸时有少量待测液溅出,Ba2+浓度测量值将 (填“偏大”或“偏小”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com