
CaCO3与稀盐酸反应(放热反应)生成CO2的量与反应时间的关系如图.下列结论正确的是()
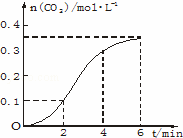
A. 反应开始4 min内温度对反应速率的影响比浓度小
B. 反应4 min后平均反应速率最小
C. 反应开始2 min内平均反应速率最大
D. 反应在第2 min到第4 min间生成CO2的平均反应速率为 v(CO2)=0.1 mo1•(L•min)﹣1
考点: 化学反应速率的影响因素.
专题: 化学反应速率专题.
分析: CaCO3与稀盐酸的反应为放热反应,随着反应的进行,温度逐渐升高,盐酸浓度逐渐降低,结合各时间段二氧化碳物质的量的变化可比较反应速率的大小,以此解答该题.
解答: 解:A.随反应进行氢离子浓度降低,氢离子浓度变化使反应速率降低,由图象可知,2~4min反应速率最快,0~4分钟温度对反应速率起主要作用,4min后反应速率又降低,氢离子浓度起主要作用,故A错误;
B.由图象可知,反应4 min后曲线斜率减小,则平均反应速率最小,故B正确;
C.由图可知,2~4分钟时间内,生成的二氧化碳的体积最多,故2~4min反应速率最快,故 C错误;
C错误;
D.2~4分钟时间内,生成二氧化碳0.2mol,因体积未知,则不能确定反应速率大小,故D错误.
故选B.
点评: 本题考查反应速率的定量表示及有关图象,侧重于学生的分析能力的考查,难度中等,注意根据速率定义式进行理解,注意理解影响反应速率的因素.


 核心素养学练评系列答案
核心素养学练评系列答案 单元期中期末卷系列答案
单元期中期末卷系列答案科目:高中化学 来源: 题型:
有一澄清透明的溶液,只可能含有大量的Fe3+、Fe2+、H+、AlO2﹣、Al3+、CO32﹣、NO3﹣七种离子中的几种,向该溶液中逐滴加入一定量1mol/L NaOH溶液的过程中,开始没有沉淀,而后才有沉淀.则下列判断正确的是( )
A. 溶液中可能含有AlO2﹣
B. 溶液中可能含有NO3﹣
C. 溶液中一定不含Fe2+和Fe3+
D. 溶液中可能含有Fe3+,但一定不含Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
某工业废水中可能含有如下几种阴阳离子:
阳离子 Fe3+、Al3+、Fe2+、Ba2+、Na+
阴离子 Cl﹣、CO32﹣、NO3﹣、SO42﹣、SiO32﹣
现对该废水样品进行以下研究:
Ⅰ.向试管中滴加浓盐酸,有少量的无色气体生成,气体遇空气立即变为红棕色;
Ⅱ.若向Ⅰ所得的溶液中加入BaCl2溶液,有白色沉淀生成.
Ⅲ.若向Ⅰ所得的溶液中加入过量的NaOH溶液,有红褐色沉淀生成.过滤后向所得滤液中通入过量的CO2气体,有白色絮状沉淀生成.
根据上述实验,回答下列问题:
(1)该废水中一定含有的阴离子是 ,一定不含有的阳离子是 ;
写出Ⅲ的所得滤液中通入过量的CO2气体生成白色絮状沉淀的离子方程式(只写这一个): ;
(3)已知用铝粉可以除去废水中的一种阴离子(X).若控制溶液的pH为10.7左右,再加入铝粉,除去X离子的同时产生氨气和氮气,且体积比为1﹕4,完成下列反应的离子方程式并配平:(X用具体的离子符号表示)
Al+ X+ 7 OH﹣= AlO2﹣+ NH3+ N2+ 2H2O ,该反应的还原产物是 .若除去0.2molX离子,要消耗铝 g.
(4)若将废水中的铁元素完全转化成Fe3+,此时测得c(Fe3+)=1.0×10﹣2mol•L﹣1,要想将其转换为Fe(OH)3沉淀而除去,则应调节溶液pH至少大于 .(已知常温下Fe(OH)3的Ksp=1.0×10﹣38)
查看答案和解析>>
科目:高中化学 来源: 题型:
大气中硫、氮的氧化物是形成酸雨的主要物质.某地酸雨中可能含有下列离子:Na+、Ba2+、NH4+、Al3+、Cl﹣、SO32﹣、SO42﹣、NO3﹣等.某研究小组取该地一定量的酸雨,浓缩后将所得澄清试液分成3份,进行如下实验:
试样 所加试剂 实验现象
第一份试液 滴加适量的淀粉KI溶液 呈蓝色
第二份试液 滴加用盐酸盐化的BaCl2溶液 有白色沉淀
第三份试液 滴加溶液,加热,加入的氢氧化钠溶液体积(V)与生成的沉淀、产生的气体关系(n)如右图. 
请回答下列问题:
(1)根据实验结果判断该酸雨中肯定不存在的离子是 .
写出试液中滴加淀粉KI溶液所发生反应的离子方程式: .
(3)设计实验方案,检验该试液中是否存在Cl﹣:
(4)该研究小组为了探究NO参与的硫酸型酸雨的形成,在烧瓶中充入含有少量NO的SO2气体,再慢慢通入O2,发生化学反应后,再喷洒适量蒸馏水即得硫酸型酸雨,则NO在上述反应中的作用是 .
(5)在0.5L密闭容器内加入NO2和SO2,为了测定在某种催化剂作用下反应:NO2(g)+SO2(g)⇌NO(g)+SO3(g)的反应速率,在t0C用气体传感器测得不同时间的NO2和SO2浓度如表(均不考虑温度变化对催化剂催化效率的影响):
时间/s 0 1 2 3 4 5
c(NO2)/mol•L﹣1 1.00×10﹣3 4.50×10﹣4 2.50×10﹣4 1.50×10﹣4 1.00×10﹣4 1.00×10﹣4
c(SO2)/mol•L﹣1 3.60×10﹣3 3.05×10﹣3 2.85×10﹣3 2.75×10﹣3 2.70×10﹣3 2.70×10﹣3
①前2s内NO的平均反应速率v(NO)= .
②t℃该反应的化学平衡常数K= .
查看答案和解析>>
科目:高中化学 来源: 题型:
铁镍蓄电池又称爱迪生电池,放电时的总反应为:Fe+Ni2O3+3H2O=Fe(OH)2+2Ni(OH)2,下列有关该电池的说法不正确的是()
A. 电池的电解液为碱性溶液,正极为Ni2O3、负极为Fe
B. 电池放电时,负极反应为Fe+2OH﹣﹣2e﹣=Fe(OH)2
C. 电池充电过程中,阴极附近溶液的pH降低
D. 电池充电时,阳极反应为2Ni(OH)2+2OH﹣﹣2e﹣=Ni2O3+3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
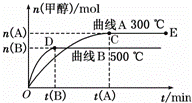
一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g)⇌CH3OH(g).根据题意完成下列问题:
(1)反应达到平衡时,平衡常数表达式K=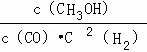 ,,升高温度,K值减小(填“增大”、“减小”或“不变”),平衡向逆反应方向移动.
,,升高温度,K值减小(填“增大”、“减小”或“不变”),平衡向逆反应方向移动.
(2)在500℃,从反应开始到平衡,氢气的平均反应速率v(H2)=.
(3)在其他条件不变的情况下,将处于E点的体系体积压缩到原来的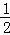 ,下列有关该体系的说法正确的是 (选填选项字母).
,下列有关该体系的说法正确的是 (选填选项字母).
A.氢气的浓度减少
B.正反应速率加快,逆反应速率也加快
C.甲醇的物质的量增加
D.重新平衡时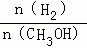 增大
增大
(4)据研究,反应过程中起催化作用的为Cu2O,反应体系中含少量CO2有利于维持催化剂Cu2O的量不变,原因是 (用化学方程式表示).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com