
| A. | 稀醋酸与NaOH溶液的反应:H++OH-═H2O | |
| B. | 铜粉与稀硝酸的反应:Cu+2H+═Cu2++H2↑ | |
| C. | 氯气与碘化钾溶液的反应:Cl2+I-═Cl-+I2 | |
| D. | 碳酸钠溶液与足量稀盐酸的反应:CO32-+2H+═CO2↑+H2O |
分析 A.醋酸为弱电解质,保留化学式;
B.不符合反应的客观事实;
C.原子个数不守恒;
D.碳酸钠溶液与足量稀盐酸的反应生成二氧化碳和水.
解答 解:A.稀醋酸与NaOH溶液的反应,离子方程式:CH3COOH+OH-═H2O+CH3COO-,故A错误;
B.铜粉与稀硝酸的反应生成硝酸铜、一氧化氮和水:3Cu+2NO3-+8H+=2NO↑+3Cu2++4H2O,故B错误;
C.氯气与碘化钾溶液的反应,离子方程式:Cl2+2I-═2Cl-+I2,故C错误;
D.碳酸钠溶液与足量稀盐酸的反应,离子方程式:CO32-+2H+═CO2↑+H2O,故D正确;
故选:D.
点评 本题考查了离子方程式的书写,明确离子方程式书写的方法及化学反应的实质是解题关键,注意化学式的拆分及原子个数守恒,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
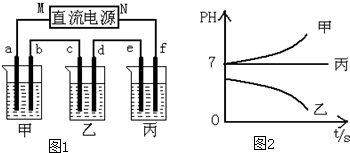
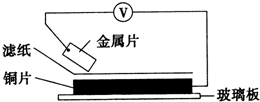 将洁净的金属片甲、乙、丙、丁分别放置在浸有某种盐溶液的滤纸上面并压紧(如图所示).在每次实验时,记录电压指针的移动方向和电压表的读数如下表:(已知构成两电极的金属其金属活泼性相差越大,电压表的读数越大.)依据记录数据判断,下列结论中正确的是( )
将洁净的金属片甲、乙、丙、丁分别放置在浸有某种盐溶液的滤纸上面并压紧(如图所示).在每次实验时,记录电压指针的移动方向和电压表的读数如下表:(已知构成两电极的金属其金属活泼性相差越大,电压表的读数越大.)依据记录数据判断,下列结论中正确的是( ) | 金属 | 电子流动方向 | 电压(V) |
| 甲 | 甲→Cu | +0.78 |
| 乙 | Cu→乙 | -0.15 |
| 丙 | 丙→Cu | +1.35 |
| 丁 | E→Cu | +0.30 |
| A. | 金属乙能从硫酸铜溶液中置换出铜 | |
| B. | 甲、乙形成合金时,将该合金露置在空气中,甲先被腐蚀 | |
| C. | 在四种金属中乙的还原性最强 | |
| D. | 甲、丁若形成原电池时,甲为正极 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
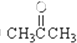 ③CH3CH2Br④
③CH3CH2Br④ ⑤
⑤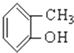 ⑥
⑥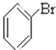 ⑦
⑦ ⑧
⑧ ⑨
⑨ ⑩
⑩
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 阳离子 | Ag+ Na+ |
| 阴离子 | NO3- SO42- Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
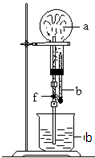 在如图装置中,烧瓶中充满干燥气体a,将滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯中的液体b呈喷泉状喷出,最终几乎充满烧瓶.a和b分别是( )
在如图装置中,烧瓶中充满干燥气体a,将滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯中的液体b呈喷泉状喷出,最终几乎充满烧瓶.a和b分别是( )| a(干燥气体) | b(液体) | |
| ① | N02 | 水 |
| ② | CO2 | 4mol•L-1NaOH溶液 |
| ③ | C12 | 饱和食盐水 |
| ④ | NH3 | l mol•L-1盐酸 |
| A. | ①和② | B. | ③和④ | C. | ①和③ | D. | ②和④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | IA和VIIA族元素间可形成共价化合物 | |
| B. | 第二周期:从左到右最高价从+1到+7 | |
| C. | 同主族的单核阴离子:还原性越强,离子半径越小 | |
| D. | 同周期金属:原子失电子能力越强,最高化合价越高 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com