
【题目】pH均为11的火碱溶液和氨水各1升,分别加水稀释到pH均10, 所加水的量
A. 前者多 B. 后者多 C. 相等 D. 无法确定
 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案科目:高中化学 来源: 题型:
【题目】有关合金的叙述正确的是
A. 合金的导电性比成分金属强
B. 多数合金比成分金属熔点高,硬度小
C. 合金的机械强度比各成分金属小
D. 多数合金比成分金属熔点低,硬度大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据能量变化示意图得出的结论正确的是( )
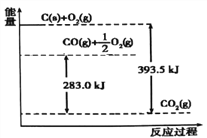
A. 1mol C完全燃烧生成CO2时放出的热量为393.5 kJ/mol
B. 2C(s)+O2(g)=2CO(g) △H=-221.0 kJ/mol
C. 2CO2 (g)=2CO(g)+O2(g) △H=+283.0 kJ/mol
D. C(s)+O2(g)= CO2 (g) △H=+393.5 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为硬脂酸甘油酯在碱性条件下水解的装置图,进行皂化反应时的步骤如下:

(1)在圆底烧瓶中加入7~8 g硬脂酸甘油酯,然后加入2~3 g的氢氧化钠、5 mL水和10 mL酒精,加入酒精的作用是________________________。
(2)隔着石棉网给反应混合物加热约10 min,皂化反应基本完成,所得的混合物为_____________(选填“悬浊液”、“乳浊液”、“溶液”或“胶体”)。
(3)向所得混合物中加入______________,静置一段时间后,溶液分为上下两层,肥皂在________层,这个操作称为____________。
(4)图中长玻璃导管的作用为__________________________。
(5)写出该反应的化学方程式:__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.某有机物燃烧只生成CO2和H2O,且二者物质的量相等,则此有机物的组成为CnH2n
B.一种烃在足量的氧气中燃烧并通过浓H2SO4,减少的体积就是生成的水蒸气的体积
C.某气态烃CxHy与足量O2恰好完全反应,如果反应前后气体体积不变(温度>100℃),则y=4;若体积减少,则y>4;否则y<4
D.相同质量的烃,完全燃烧,消耗O2越多,烃中含氢元素的质量分数就越高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F六种短周期主族元素,原子序数依次增大。其中B的单质在常温下为双原子分子,它与A的单质可形成分子X,X的水溶液呈碱性;D的简单阳离子与X具有相同电子数,且D是同周期中简单离子半径最小的元素;E元素的原子最外层比次外层少两个电子,C、F两种元素的原子最外层共有13个电子。则
(1)A的元素符号______________,D的元素名称 ____________。
(2)C在周期表中的位置为第______周期______族,E的离子结构示意图________;
(3)B、C、E分别与A形成的化合物中最稳定的是________(写化学式);E、F的最高价氧化物对应的水化物的酸性较强的是________(写化学式)
(4)F的单质在反应中常作氧化剂,该单质的水溶液与E的低价氧化物反应的离子方程式为________________。
(5)X在纯净的C单质中可以安静的燃烧,生成B的单质。该方应的化学方程式为:__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向绝热恒容密闭容器中通入SO2和NO2,一定条件下使反应SO2(g)+NO2(g) ![]() SO3(g)+NO(g)达到平衡,正反应速率随时间变化的示意图如右所示。由图可得出的正确结论是( )
SO3(g)+NO(g)达到平衡,正反应速率随时间变化的示意图如右所示。由图可得出的正确结论是( )
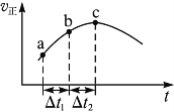
A.反应在c点达到平衡状态
B.反应物浓度:a点小于b点
C.反应物的总能量低于生成物的总能量
D.Δt1=Δt2时,SO2的转化率:a~b段小于b~c段
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将Zn棒和Cu棒用导线连接后,放入某电解质溶液中,构成如右图所示装置。试回答下列问题:
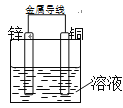
(1)若电解质溶液为稀硫酸,则Zn棒为原电池的______极(填“正”或“负”),发生_______反应(填“氧化”或“还原”), 电极反应式为___________________;Cu棒上可观察到的现象是______________________,电极反应式为______________________________。
(2)若电解质为硫酸铜溶液,则Cu棒为原电池的______极(填“正”或“负”),发生_________反应(填“氧化”或“还原”),其电极反应式为____________________________________。
(3)若在上述两个过程中,Zn棒减少的质量相等,则Cu棒上(1)和(2)所析出物质的质量之比为_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com